早教吧作业答案频道 -->化学-->
(1)在化学反应中,随着物质的变化,化学能也发生改变,还可能伴随着不同形式的能量转化.已知:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol氧气中的化学键需要吸收249kJ的能
题目详情
(1)在化学反应中,随着物质的变化,化学能也发生改变,还可能伴随着不同形式的能量转化.已知:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol氧气中的化学键需要吸收 249kJ的能量;形成水分子中1mol H-O键能够释放 463kJ能量.如图1表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在相应的横线上.
①___kJ ②___kJ ③___kJ
(2)今有2H2+O2=2H2O反应构成燃料电池,则负极通的应是___,用KOH溶液作电解质,负极的电极反应式为___,正极的电极反应式为___.
(3)若把H2改为CH3OH,用KOH溶液作电解质,则负极的电极反应式:___.
(4)电解原理在化学工业中有广泛的应用.如图2表示一个电解池,电极材料为惰性电极,U形管装有饱和食盐水;实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中阴极上的电极反应式为___,在阴极附近观察到的现象是___.
②随着气体的生成,饱和食盐水中产生了两种不同的颜色:阳极区是___色,阴极区是___色.
③电解一段时间后取出电极,将U形管内的液体搅拌混匀,又发生了化学反应,该反应的化学方程式是___;该溶液可用作消毒剂,原因是___.
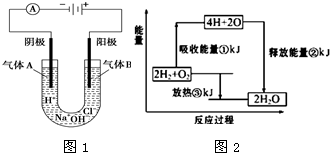
①___kJ ②___kJ ③___kJ
(2)今有2H2+O2=2H2O反应构成燃料电池,则负极通的应是___,用KOH溶液作电解质,负极的电极反应式为___,正极的电极反应式为___.
(3)若把H2改为CH3OH,用KOH溶液作电解质,则负极的电极反应式:___.
(4)电解原理在化学工业中有广泛的应用.如图2表示一个电解池,电极材料为惰性电极,U形管装有饱和食盐水;实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中阴极上的电极反应式为___,在阴极附近观察到的现象是___.
②随着气体的生成,饱和食盐水中产生了两种不同的颜色:阳极区是___色,阴极区是___色.
③电解一段时间后取出电极,将U形管内的液体搅拌混匀,又发生了化学反应,该反应的化学方程式是___;该溶液可用作消毒剂,原因是___.

▼优质解答
答案和解析
(1)①2molH2和1molO2断裂化学键吸收能量,吸收的能量为2×436kJ+2×249kJ=1370kJ,故答案为:1370;
②4moLH原子和2molO原子生成2molH2O形成4molO-H键,放出的能量为:4×463kJ=1852kJ,故答案为:1852;
③反应热等于反应物的总键能减去生成物的总键能,则2molH2和1molO2生成2molH2O放出热量为1852kJ-1370KJ=482KJ,故答案为:482;
(2)根据反应式可知H2在反应中被氧化,O2被还原,H2应在负极发生反应,O2在正极反应;
①燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,则正极:O2+2H2O+4e-=4OH-;负极的电极方程式为2H2-4e-+4OH-=4H2O,
故答案为:H2;2H2-4e-+4OH-=4H2O;O2+2H2O+4e-=4OH-;
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极甲醇失去电子生成二氧化碳,由于电解质为氢氧化钾溶液,所以反应生成了碳酸根离子,发生的负极电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(4)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,故答案为:2H++2e-=H2↑;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,所以阳极区呈现黄绿色,阴极区为红色,
故答案为:黄绿色;红;
③电极上氢离子放电,同时该电极附近生成氢氧根离子,Y电极上氯离子放电生成氯气,所以电池反应式为2NaCl+2H2O、
2NaOH+Cl2↑+H2↑,所以将U形管内的液体搅拌混匀发生了化学反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O;因为NaClO有强氧化性,所以可用作消毒剂,
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;NaClO有强氧化性.
②4moLH原子和2molO原子生成2molH2O形成4molO-H键,放出的能量为:4×463kJ=1852kJ,故答案为:1852;
③反应热等于反应物的总键能减去生成物的总键能,则2molH2和1molO2生成2molH2O放出热量为1852kJ-1370KJ=482KJ,故答案为:482;
(2)根据反应式可知H2在反应中被氧化,O2被还原,H2应在负极发生反应,O2在正极反应;
①燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,则正极:O2+2H2O+4e-=4OH-;负极的电极方程式为2H2-4e-+4OH-=4H2O,
故答案为:H2;2H2-4e-+4OH-=4H2O;O2+2H2O+4e-=4OH-;
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极甲醇失去电子生成二氧化碳,由于电解质为氢氧化钾溶液,所以反应生成了碳酸根离子,发生的负极电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(4)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,故答案为:2H++2e-=H2↑;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,所以阳极区呈现黄绿色,阴极区为红色,
故答案为:黄绿色;红;
③电极上氢离子放电,同时该电极附近生成氢氧根离子,Y电极上氯离子放电生成氯气,所以电池反应式为2NaCl+2H2O、
| ||
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;NaClO有强氧化性.
看了 (1)在化学反应中,随着物质...的网友还看了以下:
几道veryvery简单的数学分式计算题在线等,急!本人声明,好的绝不忘记采纳!1.m-1/m÷( 2020-06-05 …
已知m+1/m=4求m^2+1/m^2的值.(请写出计算过程) 2020-06-08 …
已知函数f(x)=x^2~3x+2t的两个零点为1,m.(1)m,t的值?(2)若函数f(x)=t 2020-06-11 …
已知m+1/m=2,计算(m^4+m^2+1)/m^2的值 2020-06-12 …
请问1/m + 1/m+1 + 1/m+2 .+1/m+n的计算公式是什么? 2020-06-27 …
下列各式计算正确的是?(我没找到)A.(a+1)^2=a^2+1B.a^2+a^3=a^5C.a^ 2020-07-09 …
已知方程(m^2-4)-x^2-(m-2)x+3=0是关于x的一元一次方程,则(1+m)^)^20 2020-07-31 …
如果y=(1-m)x的m方-2次方是正比例函数,且y随x的增大而减小,求m 2020-08-03 …
由不等式(M-2)大于1,得到X小于1/M-2的条件是:A,M小于2B,M大于2C,M大于3D,M 2020-08-03 …
必修一第一单元第一课:...若M国与N国的汇率比为m:n.1.M国的不变,N国的必修一第一单元第一课 2020-11-24 …