早教吧作业答案频道 -->化学-->
氮的固定是几百年来科学家一直研究的课题.(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.反应大气固氮N2(g)+O2(g)⇌2NO(g)工业固氮N2(g)+3H2(g)⇌2NH3(g)
题目详情
氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于___(填“吸热”或“放热”)反应.
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因___.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是___(填“A”或“B”);比较р1、р2的大小关系___(填“>”、“<”或“=”).
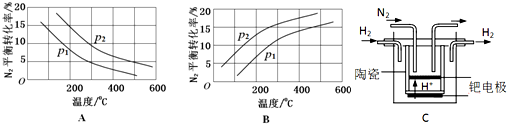
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是___.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)⇌4NH3(g)+3O2(g),则其反应热△H=___.
(已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ•mol-1)
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)⇌2NO(g) | 工业固氮 N2(g)+3H2(g)⇌2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因___.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是___(填“A”或“B”);比较р1、р2的大小关系___(填“>”、“<”或“=”).

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是___.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)⇌4NH3(g)+3O2(g),则其反应热△H=___.
(已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ•mol-1)
▼优质解答
答案和解析
(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,
故答案为:吸热;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮,
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
③合成氨反应中,反应温度越高,反应速率越快,但是该反应为放热反应,温度高转化率会降低,而且在500℃左右催化剂活性最高,所以从催化剂活性等综合因素考虑选择500℃左右合适;
故答案为:从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适;
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大;
故答案为:A;р2>р1;
(3)电解池中氮气在阴极得电子生成氨气,其电极方程式为:N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3;
(4)已知:①N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1;
故答案为:+1530 kJ•mol-1.
故答案为:吸热;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮,
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
③合成氨反应中,反应温度越高,反应速率越快,但是该反应为放热反应,温度高转化率会降低,而且在500℃左右催化剂活性最高,所以从催化剂活性等综合因素考虑选择500℃左右合适;
故答案为:从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适;
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大;
故答案为:A;р2>р1;
(3)电解池中氮气在阴极得电子生成氨气,其电极方程式为:N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3;
(4)已知:①N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1;
故答案为:+1530 kJ•mol-1.
看了 氮的固定是几百年来科学家一直...的网友还看了以下:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:(1)用CH4催化还原NOx可以消 2020-04-07 …
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:(1)用CH4催化还原NOx可以消 2020-04-07 …
氮化硼(BN)是一种重要的功能陶瓷材料。(1)在与石墨结构相似的六方氮化硼晶体中,最小环上有个B原 2020-07-05 …
氮及其化合物在生产、生活中具有重要作用.(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方 2020-07-19 …
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.(1)用CH4催化还原煤燃烧产生的氮 2020-07-20 …
氮的固定是几百年来科学家一直研究的课题.(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.反 2020-07-20 …
某班主任对班级22名学生进行了作业量多少的调查,数据如下表:在喜欢玩电脑游戏的12中,有9人认为作业 2020-12-10 …
Ⅰ.氮的固定是几百年来科学家一直研究的课题.(1)下表列举了不同温度下大气固氮和工业固氮的部分K值. 2020-12-13 …
翻译一个句子!严重警告:禁止用网业上的翻译工具!那翻译出的是中式英语!大量语法错误严重警告:禁止用网 2020-12-19 …
大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式。下表列举了不同温度下大气固氮和 2020-12-31 …