早教吧作业答案频道 -->化学-->
科学家积极探索新技术对CO2进行综合利用.I.CO2可用来合成低碳烯烃.2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H=akJ/mol请回答:(1)已知:H2和CH2=CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且
题目详情
科学家积极探索新技术对CO2进行综合利用.
I.CO2可用来合成低碳烯烃.
2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H=akJ/mol
请回答:
(1)已知:H2和CH2=CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)⇌H2O(1)△H=-44.0kJ/mol,则 a=___kJ/mol.
(2)上述由CO2合成CH2=CH2的反应在___下自发进行(填“高温”或“低温”),理由是___.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示.下列说法正确的是___.
A.平衡常数大小:KM>KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为VL的恒容容器中以n(H2):n(CO2)=3:1的投料比加入反应物,t0时达到化学平衡.t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡.请在图2中作出容器内混合气体的平均相对分子质量
随时间变化的图象.
II.利用“Na-CO2”电池将CO2变废为宝.
我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
2Na2CO3+C.放电时该电池“吸入”CO2,其工作原理如图3所示:
(5)放电时,正极的电极反应式为___.
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol e-时,两极的质量差为___g.
(7)选用髙氯酸钠-四甘醇二甲醚做电解液的优点是___(至少写两点).
I.CO2可用来合成低碳烯烃.
2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H=akJ/mol
请回答:
(1)已知:H2和CH2=CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)⇌H2O(1)△H=-44.0kJ/mol,则 a=___kJ/mol.
(2)上述由CO2合成CH2=CH2的反应在___下自发进行(填“高温”或“低温”),理由是___.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示.下列说法正确的是___.
A.平衡常数大小:KM>KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为VL的恒容容器中以n(H2):n(CO2)=3:1的投料比加入反应物,t0时达到化学平衡.t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡.请在图2中作出容器内混合气体的平均相对分子质量
| . |
| M |

II.利用“Na-CO2”电池将CO2变废为宝.
我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
| 放电 |
| |
| 充电 |
(5)放电时,正极的电极反应式为___.
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol e-时,两极的质量差为___g.
(7)选用髙氯酸钠-四甘醇二甲醚做电解液的优点是___(至少写两点).
▼优质解答
答案和解析
(1)①H2(g)+
O2(g)=H2O(l)△H=-285.8 kJ/mol;
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
③H2O(g)═H2O(l)△H=-44kJ/mol
将方程式6①-②-4③得6H2(g)+2CO2(g)
C2H4 (g)+4H2O(g)△H=6(-285.8 kJ/mol )-(-1411.0kJ/mol )-4(-44kJ/mol)=-127.8kJ/mol;
故答案为:-127.8;
(2)根据上面热化学方程式,△H<0即正向放热反应,6H2(g)+2CO2(g)
C2H4 (g)+4H2O(g)反应前后气体体积减小,熵变△S<0,满足△H-T△S<0,应在低温下能自发进行;理由是根据△G=△H-T△S,△H<0△S<0,要使反应自发进行使△G<0,需低温下进行;
故答案为:低温;根据△G=△H-T△S,△H<0△S<0,要使反应自发进行使△G<0,需低温下进行;
(3)A.升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故A正确;
B.由图象可知,其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M,故B错误;
C.若在密闭容器中充入体积比为 3:1的 H2 和CO2,设为3mol、1mol,则图中M点时二氧化碳转化率50%,
6H2(g)+2CO2(g)
C2H4 (g)+4H2O(g)
起始量(mol) 3 1 0 0
变化量(mol) 1.5 0.5 0.25 1
平衡量(mol) 1.5 0.5 0.25 1
产物CH2=CH2的体积分数=
×100%=7.7%,故图1中M点时,乙烯的体积分数为7.7%,故C正确;
D.混合气体的质量不变,体积不变,所以混合气体的密度始终不变,所以不能根据混合气体的密度来判断化学反应是否达到平衡状态,故D错误,
故答案为:AC;
(4)反应前混合气体的平均相对分子质量=
=12.5,所以起点坐标为(0,12.5),随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,若全部转化为CH2=CH2和H2O平均相对分子质量=
=20,则t0达平衡时
应在区间(12.5,20),t1时将容器体积瞬间扩大至2V L,平衡向逆方向移动,t2时重新达平衡,平均相对分子质量减小,t2达平衡时
应大于12.5,所以图象为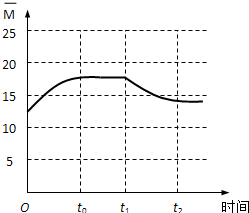 ,
,
故答案为: ;
;
Ⅱ(5)正极CO2得电子发生还原反应,故电极方程式为3CO2+4Na++4e-=2Na2CO3+C,
故答案为:3CO2+4Na++4e-=2Na2CO3+C;
(6)正极发生的电极反应
3CO2+4Na++4e-=2Na2CO3+C
3 4 2 1
0.15 0.2 0.1 0.05,
m(总)=m(Na2CO3)+m(C)=106g/mol×0.1mol+12g/mol×0.05mol=11.2g,
负极发生的电极反应
4Na-4e-=4Na+
92 4
4.6 0.2,m(Na)=4.6g,
故两极的质量差为11.2g-4.6g=6.6g,
故答案为:6.6;
(7)选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发,
故答案为:导电性好,与金属钠不反应,难挥发.
| 1 |
| 2 |
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
③H2O(g)═H2O(l)△H=-44kJ/mol
将方程式6①-②-4③得6H2(g)+2CO2(g)
| ||
故答案为:-127.8;
(2)根据上面热化学方程式,△H<0即正向放热反应,6H2(g)+2CO2(g)
| ||
故答案为:低温;根据△G=△H-T△S,△H<0△S<0,要使反应自发进行使△G<0,需低温下进行;
(3)A.升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故A正确;
B.由图象可知,其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M,故B错误;
C.若在密闭容器中充入体积比为 3:1的 H2 和CO2,设为3mol、1mol,则图中M点时二氧化碳转化率50%,
6H2(g)+2CO2(g)
| ||
起始量(mol) 3 1 0 0
变化量(mol) 1.5 0.5 0.25 1
平衡量(mol) 1.5 0.5 0.25 1
产物CH2=CH2的体积分数=
| 0.25 |
| 1.5+0.5+0.25+1 |
D.混合气体的质量不变,体积不变,所以混合气体的密度始终不变,所以不能根据混合气体的密度来判断化学反应是否达到平衡状态,故D错误,
故答案为:AC;
(4)反应前混合气体的平均相对分子质量=
| 44×2+2×6 |
| 2+6 |
| 28+18×4 |
| 1+4 |
. |
| M |
. |
| M |
 ,
,故答案为:
 ;
;Ⅱ(5)正极CO2得电子发生还原反应,故电极方程式为3CO2+4Na++4e-=2Na2CO3+C,
故答案为:3CO2+4Na++4e-=2Na2CO3+C;
(6)正极发生的电极反应
3CO2+4Na++4e-=2Na2CO3+C
3 4 2 1
0.15 0.2 0.1 0.05,
m(总)=m(Na2CO3)+m(C)=106g/mol×0.1mol+12g/mol×0.05mol=11.2g,
负极发生的电极反应
4Na-4e-=4Na+
92 4
4.6 0.2,m(Na)=4.6g,
故两极的质量差为11.2g-4.6g=6.6g,
故答案为:6.6;
(7)选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发,
故答案为:导电性好,与金属钠不反应,难挥发.
看了 科学家积极探索新技术对CO2...的网友还看了以下:
(m0h4•黔西南州)&nhsp;如图是A、h、C三种固体物质的溶解度曲线,请回答.(h)th℃时 2020-05-15 …
化学电离选择题选择题:当不考虑水的电离时,在氢硫酸溶液中,下列的离子浓度关系中正确的是()A.c( 2020-06-04 …
高中化学问题,求解答!等质量的烃完全燃烧,看哪种烃消耗氧气最多.为什么H、C原子个数比值大的烃耗. 2020-06-25 …
这个通达信指标是什么意思内外盘差}PJ:=(H+L+C)/3;V1:=IF(H=L,1,H-MAX 2020-07-09 …
运用相关原理,回答下列各小题:Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++ 2020-07-15 …
已知25℃时CH3COOH的Ka=1.8×10-5.回答下列问题:(1)常温下,0.1mol•L- 2020-07-20 …
下图为水循环示意图,读图回答题。1.能正确反映海陆间水循环过程的是2.水循环中的A.a→f→h→gB 2020-12-03 …
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:(1)C、N、O三种元素第一电离能从大 2020-12-07 …
H、C、N、O是几种重要的非金属元素.回答以下问题:(1)C、N、O三种元素第一电离能从大到小的顺序 2020-12-07 …
回答下列问题:(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小 2021-01-12 …