早教吧作业答案频道 -->化学-->
CO2和CH4均为温室气体,研究它们具有重要的意义.(1)已知CH4、H2、CO的燃烧热△H分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol则CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=kJ/mol.(2)以CO2和NH3为原
题目详情
CO2和CH4均为温室气体,研究它们具有重要的意义.
(1)已知CH4、H2、CO的燃烧热△H分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol则CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=___kJ/mol.
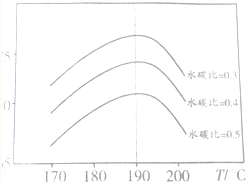
(2)以CO2和NH3为原料合成尿素是研究CO2的成功范例.在尿素合成塔中反应如下:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H=-86.98kJ/mol反应中影响CO2平衡转化率的因素很多,如图为特定条件下,不同水碳比
和温度对CO2平衡转化率的影响曲线.
①为提高CO2的转化率,生产中除控制温度外,还可采取的措施有___、___
②当温度高于190℃,CO2平衡转化率出现如图所示的变化趋势,其原因是___
(3)向1.0L的密闭容器中通入0.2mol NH3和0.1mol CO2,在一定的温度下,发生反应2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),反应时间与气体总压强p的数据如下表:
用起始压强和总压强计算平衡时NH3 的转化率为___,0-80min内CO2的平均反应速率是___.
(4)氨基甲酸铵NH2COONH4极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=___;NH4+水解平衡常数值为___.

(1)已知CH4、H2、CO的燃烧热△H分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol则CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=___kJ/mol.
(2)以CO2和NH3为原料合成尿素是研究CO2的成功范例.在尿素合成塔中反应如下:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H=-86.98kJ/mol反应中影响CO2平衡转化率的因素很多,如图为特定条件下,不同水碳比
| n(H2O) |
| n(CO2) |
①为提高CO2的转化率,生产中除控制温度外,还可采取的措施有___、___
②当温度高于190℃,CO2平衡转化率出现如图所示的变化趋势,其原因是___
(3)向1.0L的密闭容器中通入0.2mol NH3和0.1mol CO2,在一定的温度下,发生反应2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),反应时间与气体总压强p的数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 65 | 80 | 100 |
| 总压强p/100kPa | 9.53 | 7.85 | 6.37 | 5.78 | 5.24 | 4.93 | 4.67 | 4.45 | 4.45 |
(4)氨基甲酸铵NH2COONH4极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=___;NH4+水解平衡常数值为___.
▼优质解答
答案和解析
已知CH4、H2和CO的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1、283.0kJ•mol-1,热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②H2(g)+
O2(g)=H2O(l)△H=-285.8kJ•mol-1
③CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律①-②×2-③×2得到:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol,
故答案为:+247.3;
(2)①反应Ⅲ:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是增大压强降低水碳比,二氧化碳转化率增大,
故答案为:增大压强,降低水碳比;
②反应Ⅲ:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,是放热反应,升温高于190°C,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(3)依据化学平衡三行计算列式,气体压强之比等于气体物质的量之比,设氨气消耗物质的量x,
2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),
起始量在(mol) 0.2 0.1 0 0
变化量(mol) x 0.5x 0.5x 0.5x
平衡量(mol) 0.2-x 0.1-0.5x 0.5x 0.5x
气体压强之比等于气体物质的量之比,图表中可知80min反应达到平衡状态,
=
x=0.16mol
平衡时NH3 的转化率=
×100%=
×100%=80%,
0-80min内CO2的反应速率v=
=
=0.001mol/(L•min),
故答案为:80%;0.001mol/(L•min);
(4)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O⇌(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,
NH4++H2O⇌NH3•H2O+H+;
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数K=
=
=4×10-9,
故答案为:0.1mol/L;4×10-9;
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
依据盖斯定律①-②×2-③×2得到:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol,
故答案为:+247.3;
(2)①反应Ⅲ:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是增大压强降低水碳比,二氧化碳转化率增大,
故答案为:增大压强,降低水碳比;
②反应Ⅲ:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,是放热反应,升温高于190°C,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(3)依据化学平衡三行计算列式,气体压强之比等于气体物质的量之比,设氨气消耗物质的量x,
2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),
起始量在(mol) 0.2 0.1 0 0
变化量(mol) x 0.5x 0.5x 0.5x
平衡量(mol) 0.2-x 0.1-0.5x 0.5x 0.5x
气体压强之比等于气体物质的量之比,图表中可知80min反应达到平衡状态,
| 0.2+0.1 |
| 02-x+0.1-0,5x+0.5x+0.5x |
| 9.53 |
| 4.45 |
x=0.16mol
平衡时NH3 的转化率=
| 消耗量 |
| 起始量 |
| 0.16mol |
| 0.2mol |
0-80min内CO2的反应速率v=
| △c |
| △t |
| ||
| 80min |
故答案为:80%;0.001mol/(L•min);
(4)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O⇌(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,
NH4++H2O⇌NH3•H2O+H+;
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数K=
| c(NH3•H2O)c(H+) |
| c(NH4+) |
| 0.004×10-7 |
| 0.1 |
故答案为:0.1mol/L;4×10-9;
看了 CO2和CH4均为温室气体,...的网友还看了以下:
Matlab求帮忙看看哪里错了.h=0;%h[0,51.5]a=15;m=sMatlab求帮忙看看 2020-05-13 …
EXCEL公式有什么区别,第一个括号前2个条件,第二个括号3个条件?=SUMPRODUCT(($B 2020-05-15 …
关于沉淀溶解度的计算,在考虑酸效应时有个公式αA(H)=1+β1*〔H+〕+β2*〔H+〕^2在这 2020-06-02 …
下面是围棋棋盘的一角.白棋的位置分别是F(2,2)G(3,3)H(4,2)I(4,1)如果下一步该 2020-06-12 …
符号“H”表示一种运算,它对正整数的运算结果如下:H(1)=-2,H(2)=3,H(3)=-4,H 2020-07-18 …
先用分离系数法求出f(x)除以g(x)所得的商式和余式,不再作除法,写出f(x)除以h(x)的商式 2020-07-30 …
导数题设f(5)=5,f'(5)=3,g(5)=4,g'(5)=1在下列情况下求h(5)和h'(5 2020-07-30 …
高数一习题2.4求下列极限2)lim(x趋于根号2)(x^2-2/x^4+2x^2)这个题怎么做?我 2020-12-03 …
1.1nmile约合1852m,根据这一关系写出米数y关于海里数x的函数解析式2.已知函数h(x)= 2020-12-08 …
麻烦哪位大大帮我算下这三个半弧形的面积,(L=23.3,H=3)(L=20.3,H=2.6)(L=1 2020-12-25 …