早教吧作业答案频道 -->化学-->
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.Ⅰ.已知:CO的燃烧热为283KJ•mol-1,2Fe(s)+32O2(g
题目详情
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.
Ⅰ.已知:CO的燃烧热为283KJ•mol-1,2Fe(s)+
O2(g)=Fe2O3(s)△H=-825.5KJ•mol-1.
(1)反应:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=___KJ•mol-1
Ⅱ.反应
Fe2O3(s)+CO(g)═
Fe(s)+CO2(g)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡CO的平衡转化率为60%.
(2)在1000℃的平衡常数等于___.
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是___.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
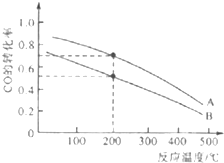
Ⅲ.高炉炼铁产生的废气中CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)═CH3OH(g).请根据图示回答下列问题:
(4)图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强为5.0MPa的曲线是___(填“A”或“B”)
(5)该反应在进行的过程中,v正(H2)___v逆(CO)+v正(CH2OH)(填“>”“<”或“=”)
(6)在不改变反应混合物用量的前提下,为了加快反应速率且提高CO的转化率,可采取的最佳措施是___.
(7)甲醇可与氯气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式:___.
Ⅰ.已知:CO的燃烧热为283KJ•mol-1,2Fe(s)+
| 3 |
| 2 |

(1)反应:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=___KJ•mol-1
Ⅱ.反应
| 1 |
| 3 |
| 2 |
| 3 |
(2)在1000℃的平衡常数等于___.
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是___.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
Ⅲ.高炉炼铁产生的废气中CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)═CH3OH(g).请根据图示回答下列问题:
(4)图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强为5.0MPa的曲线是___(填“A”或“B”)
(5)该反应在进行的过程中,v正(H2)___v逆(CO)+v正(CH2OH)(填“>”“<”或“=”)
(6)在不改变反应混合物用量的前提下,为了加快反应速率且提高CO的转化率,可采取的最佳措施是___.
(7)甲醇可与氯气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式:___.
▼优质解答
答案和解析
(1)已知:①CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol,②2Fe(s)+
O2(g)=Fe2O3(s)△H=-825.5KJ•mol-1,①×3-②得到反应:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),该反应的△H=(-283kJ/mol)×3-(-825.5KJ•mol-1)=-23.5kJ/mol,
故答案为:-23.5kJ/mol;
(2)反应
Fe2O3(s)+CO(g)=Fe2O3(s)+CO2(g)的平衡常数K=
,
Fe2O3(s)+CO(g)=Fe2O3(s)+CO2(g)
初始浓度:0.1 0.1
变化浓度:0.06 0.18
平衡浓度:0.04 0.28
K=
=7,
故答案为:7;
(3)a、该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故A错误;
b、增加压强,平衡逆向移动,CO的平衡转化率减小,故b错误;
c、选取合适的催化剂,不影响平衡移动,CO的平衡转化率不变,故c错误;
d、及时吸收或移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
故选d.
(4)比较压强,统一温度,在相同温度200℃时,A的转化率比B的高,说明压强改变,平衡正向移动,对于CO(g)+2H2(g)⇌CH3OH(g),是气体体积缩小的反应,则压强的改变只能是增大压强,所以A点的压强大,为5.0MPa,
故答案为:A;
(5)反应速率之比等于各物质计量数之比,达平衡时,v逆(CO)=v正(CH3OH)=
v正(H2),即v正(H2)=v逆(CO)+v正(CH3OH),在达平衡之前,正反应速率大于逆反应速率,即v正(CH3OH)>v逆(CO),故达平衡前v正(H2)>v逆(CO)+v正(CH3OH),
故答案为:>;
(6)不改变反应混合物用量的前提下,用温度、压强对化学平衡产生影响,从图中可知,升温CO的转化率降低,降温速率会减慢,所以选择增大压强,加快反应速率且平衡正向移动,提高CO的转化率,
故答案为:其他条件不变,增大压强;
(7)燃料电池的负极通入燃料,失去电子发生氧化反应,在碱性环境的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:-23.5kJ/mol;
(2)反应
| 1 |
| 3 |
| c(CO2) |
| c(CO) |
| 1 |
| 3 |
初始浓度:0.1 0.1
变化浓度:0.06 0.18
平衡浓度:0.04 0.28
K=
| 0.28 |
| 0.04 |
故答案为:7;
(3)a、该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故A错误;
b、增加压强,平衡逆向移动,CO的平衡转化率减小,故b错误;
c、选取合适的催化剂,不影响平衡移动,CO的平衡转化率不变,故c错误;
d、及时吸收或移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
故选d.
(4)比较压强,统一温度,在相同温度200℃时,A的转化率比B的高,说明压强改变,平衡正向移动,对于CO(g)+2H2(g)⇌CH3OH(g),是气体体积缩小的反应,则压强的改变只能是增大压强,所以A点的压强大,为5.0MPa,
故答案为:A;
(5)反应速率之比等于各物质计量数之比,达平衡时,v逆(CO)=v正(CH3OH)=
| 1 |
| 2 |
故答案为:>;
(6)不改变反应混合物用量的前提下,用温度、压强对化学平衡产生影响,从图中可知,升温CO的转化率降低,降温速率会减慢,所以选择增大压强,加快反应速率且平衡正向移动,提高CO的转化率,
故答案为:其他条件不变,增大压强;
(7)燃料电池的负极通入燃料,失去电子发生氧化反应,在碱性环境的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
看了 钢铁工业是国民经济的重要基础...的网友还看了以下:
球的体积公式是V=4/3πr的三次方,将两个半径为5.2cm的小铁球熔炼成一个大铁球,已知每立方米 2020-05-13 …
(2010•徐汇区一模)钢铁是重要的金属材料,在生产、生活中有广泛的用途.炼铁厂常以焦炭、赤铁矿( 2020-06-24 …
高炉炼铁是冶炼铁的主要方法.(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体(填化学式),�高炉 2020-07-10 …
关于铁矿石炼铁的说法中不正确的()A.用铁矿石炼铁的设备是高炉B.炼铁需要的材料有铁矿石、焦炭、石 2020-07-10 …
某炼铁厂用含杂质10%的赤铁矿(主要成分是氧化铁)冶炼生铁.求800吨这种矿石可炼出含杂质4%的生 2020-07-14 …
关于铁矿石炼铁的说法中不正确的()A.用铁矿石炼铁的设备是高炉B.炼铁需要的材料有铁矿石、焦炭、石 2020-07-14 …
赤铁矿石是炼铁的重要原料,其主要成分为氧化铁(Fe2O3).(1)请用方程式写出以赤铁矿为原料进行炼 2020-11-01 …
下列不属于化学变化的是()1、铁被磁铁吸引2、生铁炼成钢3、铁丝导电4、铁生锈5、用铁矿石炼生铁下列 2020-11-10 …
某工厂要用赤矿石来炼生铁,若要炼制含铁96%的生铁63t,若要炼制含铁96%的生铁63t,假设炼制过 2020-11-10 …
把赤铁矿冶炼成铁是一个复杂的过程,请写出在钢铁厂用还原剂从含Fe2O3(2,3是小写的哦,2,3中间 2020-11-30 …