甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+H2(g)CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g)ΔH1=-283.0kJ/mol;②H2(g)+1/2O2(g)=H2O(g)ΔH2=-241.8kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2
甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO![]() (g)+H2(g)
(g)+H2(g)![]()
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:
(1)计算CO(g)+2H2(g)![]() CH3OH(g)的反应热ΔH4=_________________。
CH3OH(g)的反应热ΔH4=_________________。
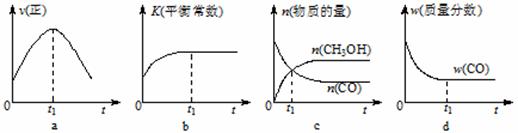
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是_______
CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是_______![]() _(填选项字母)。
_(填选项字母)。
 |
 (3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______5 L(填“>、<或=”);T1℃时,CO(g)+2H2(g)
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______5 L(填“>、<或=”);T1℃时,CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=____________。
CH3OH(g)的平衡常数K=____________。
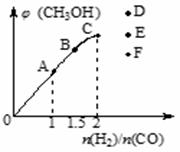
(4)在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和
CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的
关系如图所示。温度不变,当n(H2)/n(CO)=2.5时,达到平
衡状态,CH3OH的体积分数可能是图象中的 点。
(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极![]() 反应式________________________________________________。
反应式________________________________________________。
(1)-574.4 kJ/mol(2分)
(2)d(2分)
(3)>(1分);625(2分)
(4)F(1分)
(5)CH3OH+8OH–-6e–=CO32–+6H2O(2分)
根据电荷守恒关系,得出的关系式如何理解(如NA2SO4,KNO3,HCl的混合液)C(K+)*1+ 2020-05-13 …
常温下,0.1mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是 2020-05-14 …
常温下,0.1mol•L-1某一元酸HA溶液中c(OH−)c(H+)=1×10-8.下列叙述正确的 2020-05-14 …
常温下,0.1mol•L-1某一元酸HA溶液中c(OH−)c(H+)=1×10-8.下列叙述正确的 2020-05-14 …
常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH−)c(H+)=1×10-8,下列叙述正 2020-05-14 …
已知反应N2H4=2NH2反应焓变为247KJ每摩尔.则△H是N与N之间的A单键键能B三键键能C平 2020-07-19 …
0.1mol·L-1的甲酸与0.1mol·L-1的氢氧化钠等体积混合,下列表示所得溶液中的粒子浓度 2020-07-24 …
两种不同浓度的NaOH溶液,c(H+)分别为1.0×10-14mol/L和c(H+)=1.0×10 2020-07-27 …
25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:为 2020-11-01 …
水的离子积纯水中c(H+)为10的-7次方,c(OH-)为10的-7次方,加入氯化铵,若此时水电离出 2020-11-21 …