早教吧作业答案频道 -->化学-->
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.Ⅰ.(1)合成二甲醚反应一:3H2(g)+2CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol一定条件下该反应在密闭容器中达到平衡后,要
题目详情
二甲醚(CH 3 OCH 3 )被称为21世纪的清洁、高效能源.
Ⅰ.(1)合成二甲醚反应一:
3H 2 (g)+2CO(g)?CH 3 OCH 3 (g)+CO 2 (g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A、低温高压 B、加催化剂 C、体积不变充入N 2
D、增加CO浓度 E、分离出二甲醚
(2)合成二甲醚反应二:2CH 3 OH(g)?CH 3 OCH 3 (g)+H 2 O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH 3 OH,反应达到平衡,测得各组分的浓度如表:‘
该反应是______(填“放热”或“吸热”)反应,原因是______(从平衡常数角度说明).
Ⅱ.二甲醚燃料电池的工作原理如下图一所示.
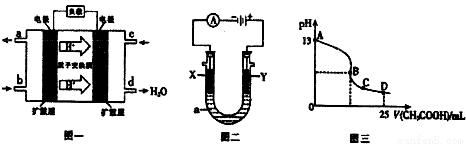
(1)该电池正极的电极反应式为______.
电池在放电过程中,b对应的电极溶液的pH______.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,写出电解总反应的离子方程式为______ Cl 2 ↑+H 2 ↑+2OH -
Ⅰ.(1)合成二甲醚反应一:
3H 2 (g)+2CO(g)?CH 3 OCH 3 (g)+CO 2 (g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A、低温高压 B、加催化剂 C、体积不变充入N 2
D、增加CO浓度 E、分离出二甲醚
(2)合成二甲醚反应二:2CH 3 OH(g)?CH 3 OCH 3 (g)+H 2 O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH 3 OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH 3 OH | CH 3 OCH 3 | H 2 O | ||
| 1 | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
Ⅱ.二甲醚燃料电池的工作原理如下图一所示.

(1)该电池正极的电极反应式为______.
电池在放电过程中,b对应的电极溶液的pH______.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,写出电解总反应的离子方程式为______ Cl 2 ↑+H 2 ↑+2OH -
▼优质解答
答案和解析
分析:
Ⅰ、(1)要提高CO的转化率,应使平衡向正反应分析移动;(2)计算出平衡,比较升高温度时平衡常数的变化,可判断反应热;Ⅱ、(1)正极发生还原反应,氧气得电子被还原,由氢离子移动方向可知左侧电极为负极,右侧电极为正极;(2)电解KCl溶液,生成KOH、氢气和氧气;(3)醋酸为弱酸,恰好中和时溶液呈碱性,pH>7,C点醋酸过量,溶液呈酸性.
Ⅰ、(1)A正反应放热,则降低温度可使平衡向正方向移动,增大压强平衡向正方向移动,故A正确;B.加入催化剂平衡不移动,故B错误;C.体积不变充入N2,平衡不移动,故C错误;D.增加CO浓度,CO的转化率降低,故D错误;E.分离出二甲醚,可使平衡向正方向移动,故答案为:AE;(2)平衡时K(403)==400,K(453)==300,说明升高温度平衡常数减小,则反应向逆方向移动,所以正反应应为放热反应,故答案为:放热;K(403)==400,K(453)==300,K(403)>K(453),所以该反应为放热反应;Ⅱ、(1)正极发生还原反应,氧气得电子被还原,电极反应为4H++O2+4e-=2H2O,由氢离子移动方向可知左侧电极为负极,右侧电极为正极,负极反应为CH3OCH3+3H2O-12e-=12H++2CO2,生成H+,pH减小,故答案为:4H++O2+4e-=2H2O;减小;(2)电解KCl溶液,生成KOH、氢气和氧气,总反应式为2Cl-+2H2OCl2↑+H2↑+2OH-,故答案为:2Cl-+2H2OCl2↑+H2↑+2OH-;(3)①醋酸为弱酸,恰好中和时溶液呈碱性,pH>7,应为与AB之间,故答案为:AB;②C点醋酸过量,溶液呈酸性,应有c(CH3COO-)>c(K+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-).
点评:
本题考查较为综合,涉及化学平衡的移动,原电池与电解池以及离子浓度的大小比较,题目难度中等,注意把握电极方程式的书写以及平衡常数的意义.
分析:
Ⅰ、(1)要提高CO的转化率,应使平衡向正反应分析移动;(2)计算出平衡,比较升高温度时平衡常数的变化,可判断反应热;Ⅱ、(1)正极发生还原反应,氧气得电子被还原,由氢离子移动方向可知左侧电极为负极,右侧电极为正极;(2)电解KCl溶液,生成KOH、氢气和氧气;(3)醋酸为弱酸,恰好中和时溶液呈碱性,pH>7,C点醋酸过量,溶液呈酸性.
Ⅰ、(1)A正反应放热,则降低温度可使平衡向正方向移动,增大压强平衡向正方向移动,故A正确;B.加入催化剂平衡不移动,故B错误;C.体积不变充入N2,平衡不移动,故C错误;D.增加CO浓度,CO的转化率降低,故D错误;E.分离出二甲醚,可使平衡向正方向移动,故答案为:AE;(2)平衡时K(403)==400,K(453)==300,说明升高温度平衡常数减小,则反应向逆方向移动,所以正反应应为放热反应,故答案为:放热;K(403)==400,K(453)==300,K(403)>K(453),所以该反应为放热反应;Ⅱ、(1)正极发生还原反应,氧气得电子被还原,电极反应为4H++O2+4e-=2H2O,由氢离子移动方向可知左侧电极为负极,右侧电极为正极,负极反应为CH3OCH3+3H2O-12e-=12H++2CO2,生成H+,pH减小,故答案为:4H++O2+4e-=2H2O;减小;(2)电解KCl溶液,生成KOH、氢气和氧气,总反应式为2Cl-+2H2OCl2↑+H2↑+2OH-,故答案为:2Cl-+2H2OCl2↑+H2↑+2OH-;(3)①醋酸为弱酸,恰好中和时溶液呈碱性,pH>7,应为与AB之间,故答案为:AB;②C点醋酸过量,溶液呈酸性,应有c(CH3COO-)>c(K+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-).
点评:
本题考查较为综合,涉及化学平衡的移动,原电池与电解池以及离子浓度的大小比较,题目难度中等,注意把握电极方程式的书写以及平衡常数的意义.
看了 二甲醚(CH3OCH3)被称...的网友还看了以下:
初一一道关于整式运算的数学题.."如果(m-2)(m-k)=m^2-pm-6,则k=( ),p=( 2020-05-13 …
开头字母是K的英文名我叫杨骐祯 想要一个K开头的英文名 不要拼音 目前只有10分. 2020-05-14 …
一次函数Y=1/2X-2的图像分别交于X轴,Y轴于A,B,P为AB的中点,PC⊥X轴于点C,PC的 2020-06-14 …
带“一"的成语读音都是yi的第一声吗?要"一”为首字.什么“一刀两断,一了百了,一丘之貉,一无所长 2020-06-16 …
火火火三角函数之综合给定一个假设:所有正角表示为k×360+212.5(k∈N),所有—k×360 2020-06-21 …
帮忙看一下今年全国文科数学大纲卷最后一题第一问.k=2(x0+1),答案为什么要考虑x0=1时不符 2020-06-26 …
特地来像你请教的,如果矩阵A的特征值为a,b,c.那么矩阵KE+A的特征值为K+a,K+b,K+c? 2020-11-02 …
如果矩阵A的特征值为a,b,c.那么矩阵KE+A的特征值为K+a,K+b,K+c?1、这里要求A是方 2020-11-02 …
一元二次方程根的分布情况,如下,1.两根都大于k:的塔>=o,-b/2a>k,f(k)>o2.两根都 2020-11-12 …
G是初二学生,与K同座。G经常抄K的作业,有时候不打招呼就把K没做完的作业抢去抄写。这样,K自己的学 2020-11-27 …