早教吧作业答案频道 -->化学-->
锡是第IVA族金属元素,常见化合价为+2、+4价,其单质及化合物在生活、生产中有重要应用.已知:Sn熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点-33℃、沸点114℃.请按要求回答
题目详情
锡是第IVA族金属元素,常见化合价为+2、+4价,其单质及化合物在生活、生产中有重要应用.已知:Sn熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点-33℃、沸点114℃.请按要求回答下列相关问题:
(1)如图为锡原子结构示意图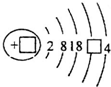 ,请补充完整:
,请补充完整:
(2)用于微电子器件生产的锡粉纯度测定:
①取2.38g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.2000mol•L-1K2Cr2O7溶液滴定步骤②得到的溶液(产物中Cr呈+3价),消耗25,.00mL.步骤②中加入Fe2(SO4)3发生反应的离子方程式为___;此锡粉样品中锡的质量分数为___.
(3)实验室配制SnCl2溶液时:要先将SnCl2固体___,并在新配制的SnCl2溶液中加入___,目的是___.
(4)SnO不溶于水,工业上常用于制备SnSO4.向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,写出反应的离子方程式___.
(5)现有如图下列装置,某化学实验小组要在实验室中制备少量SnCl4,请回答下列问题:
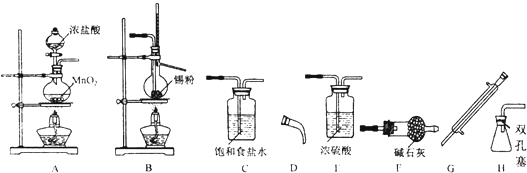
①所选择的仪器装置及合理的先后排列顺序是:A→___.
②实验中当开始生成SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是___.
(1)如图为锡原子结构示意图
 ,请补充完整:
,请补充完整:(2)用于微电子器件生产的锡粉纯度测定:
①取2.38g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.2000mol•L-1K2Cr2O7溶液滴定步骤②得到的溶液(产物中Cr呈+3价),消耗25,.00mL.步骤②中加入Fe2(SO4)3发生反应的离子方程式为___;此锡粉样品中锡的质量分数为___.
(3)实验室配制SnCl2溶液时:要先将SnCl2固体___,并在新配制的SnCl2溶液中加入___,目的是___.
(4)SnO不溶于水,工业上常用于制备SnSO4.向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,写出反应的离子方程式___.
(5)现有如图下列装置,某化学实验小组要在实验室中制备少量SnCl4,请回答下列问题:

①所选择的仪器装置及合理的先后排列顺序是:A→___.
②实验中当开始生成SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是___.
▼优质解答
答案和解析
(1)锡为50号元素,质子数为50,根据核外电子排布规律可知其原子核外电子排布为2、8、18、18、4,原子结构示意图为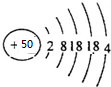 ,
,
故答案为: ;
;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,同时生成Fe2+,反应的离子方程式为2Fe3++Sn2+=2Fe2++Sn4+,根据元素守恒及电子得失守恒有关系式3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7,K2Cr2O7的物质的量为0.2000mol•L-1×0.025L=0.005mol,所以锡的物质的量为0.015mol,则锡的质量分数为
×100%=75%,
故答案为:2Fe3++Sn2+=2Fe2++Sn4+;75%;
(3)Sn2+易水解、易被氧化,所以实验室配制SnCl2溶液时要防止其水解及发生氧化反应,要先将SnCl2固体溶于少量浓盐酸中,并在新配制的SnCl2溶液中加入少量锡粉,
故答案为:少量浓盐酸;锡粉;防止其水解及发生氧化反应;
(4)向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,同时还有二氧化碳和氯化铵生成,反应的离子方程式为Sn2++2HCO3-=SnO↓+2CO2↑+H2O,
故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
(5)SnCl4极易水解,反应应在无水环境下进行进行,A中发生反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,所以要用饱和食盐水除去HCl,可以降低氯气的溶解,浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在B中反应生成SnCl4,经冷凝后用H装置进行收集SnCl4,未反应的氯气,用干燥管中碱石灰吸收,同时又可以防止空气中的水分进入H中使产物水解,
①根据上面的分析可知,仪器装置及合理的先后排列顺序是A→C→E→B→G→D→H→F,
故答案为:C→E→B→G→D→H→F;
②由于锡与氯气的反应为放热反应,所以当开始生成SnCl4时即可熄灭B处酒精灯,反应仍可持续进行,
故答案为:锡与氯气的反应为放热反应.
 ,
,故答案为:
 ;
;(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,同时生成Fe2+,反应的离子方程式为2Fe3++Sn2+=2Fe2++Sn4+,根据元素守恒及电子得失守恒有关系式3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7,K2Cr2O7的物质的量为0.2000mol•L-1×0.025L=0.005mol,所以锡的物质的量为0.015mol,则锡的质量分数为
| 0.015mol×119g/mol |
| 2.38g |
故答案为:2Fe3++Sn2+=2Fe2++Sn4+;75%;
(3)Sn2+易水解、易被氧化,所以实验室配制SnCl2溶液时要防止其水解及发生氧化反应,要先将SnCl2固体溶于少量浓盐酸中,并在新配制的SnCl2溶液中加入少量锡粉,
故答案为:少量浓盐酸;锡粉;防止其水解及发生氧化反应;
(4)向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,同时还有二氧化碳和氯化铵生成,反应的离子方程式为Sn2++2HCO3-=SnO↓+2CO2↑+H2O,
故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
(5)SnCl4极易水解,反应应在无水环境下进行进行,A中发生反应:MnO2+4HCl(浓)
| ||
①根据上面的分析可知,仪器装置及合理的先后排列顺序是A→C→E→B→G→D→H→F,
故答案为:C→E→B→G→D→H→F;
②由于锡与氯气的反应为放热反应,所以当开始生成SnCl4时即可熄灭B处酒精灯,反应仍可持续进行,
故答案为:锡与氯气的反应为放热反应.
看了 锡是第IVA族金属元素,常见...的网友还看了以下:
一个容器装有1L的水,按照如下要求把水倒出:第一次到处二分之一水,第二次倒出的水量是1/2 L的1 2020-05-16 …
28岁女性,闭经3年,MRI检查发现垂体腺瘤,高度3.0cm,压迫视神经交叉住院进一步检查,体检轻度 2020-06-05 …
已知两点P(-2,2),Q(0,2)以及一条直线:L:y=x,设长为2的线段AB在直线L上移动,如 2020-06-12 …
(1/2)在水平面上垒砖,每块砖都是均匀的,长都是L.每垒一块砖都往同一边移过L/a距离,a是整数 2020-06-25 …
某煤炭公司每天生产媒X吨的总成本函数为C(X)=2000+450X+0.02X^2如果每吨煤的销售 2020-07-06 …
10ml0.10mol/l硫酸铜溶液与10ml6mol/l氨水混合并达到平衡,计算溶液中铜离子氨水 2020-07-16 …
曲面积分设L为由y^2=x+3及x=2围成的区域边界,去逆时针方向,则∮L(xdy-ydx)/(x 2020-07-31 …
想在matlab里面实现,已知S和R的关系,见'补充'.L已知,S自变量,R因变量,想根据S的值计 2020-08-01 …
水质硬度换算1、铁锰含量小于0.1mg/L,钙镁含量小于0.03mmol/L(CaC03计硬度3mg 2020-11-01 …
(23个p•赤峰模拟)水的硬度表示方法是:将水j的Ca2+、Mg2+质量折算成CaO的质量.通常把个 2020-12-03 …