早教吧作业答案频道 -->化学-->
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
题目详情
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H 1=+489.0kJ•mol-1,C(s)+CO2(g)=2CO(g)△H 2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为___.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的负极反应式:___.
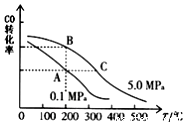
(3)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
①CO的平衡转化率(α)与温度、压强的关系如图所示.
B、C两点的平衡常数K(B)___ K(C)(填“>”、“=”或“<”).
②某温度下,将2.0molCO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率=___,此温度下的平衡常数K=___(保留二位有效数字)

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H 1=+489.0kJ•mol-1,C(s)+CO2(g)=2CO(g)△H 2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为___.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的负极反应式:___.
(3)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
①CO的平衡转化率(α)与温度、压强的关系如图所示.
B、C两点的平衡常数K(B)___ K(C)(填“>”、“=”或“<”).
②某温度下,将2.0molCO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率=___,此温度下的平衡常数K=___(保留二位有效数字)
▼优质解答
答案和解析
(1)①由①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳在溶液中生成碳酸钾,原电池负极电极反应为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,故答案为:=;
②将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.0 3.0 0
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率
×100%=75%,此温度下的化学平衡常数K=
=
≈1.3,故答案为:75%,1.3.
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳在溶液中生成碳酸钾,原电池负极电极反应为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,故答案为:=;
②将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.0 3.0 0
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率
| 0.75 |
| 1 |
| c(CH3OH) |
| c(CO)•c3(H2) |
| 0.75 |
| 0.25×1.52 |
看了 研究和深度开发CO、CO2的...的网友还看了以下:
已知△ABC的顶点坐标是A(-1,5),B(-5,5),C(-6,2)(1)分别写出点A,B,C关 2020-05-13 …
已知△ABC的顶点坐标是A(-1,5),B(-5,5),C(-6,2)(1)分别写出点A,B,C关 2020-05-13 …
下列各组数种,互为相反数的是( ) A.+(-8)和8 B.-(-5)和5 C.-(+7)和-7 2020-05-15 …
问一个关于勾股定理的问题a=b=5,c=根号5为什么不能组成直角三角形a方加b方就是等于c方啊?打 2020-06-10 …
急小王师傅把一根5米长的木料用电锯锯了6次锯成了相等的小段每小段长小王师傅把一根5米长的木料,用电 2020-07-07 …
matlab如何求解如下的微分方程?有一组电容电压C-V数据求解这组数据所构成的曲线上的满足如下方 2020-07-23 …
请大家帮忙将这两个公式合二为一A1:=MA(C,5);A2:=MA(C,10);A3:=MA(C, 2020-07-23 …
求abc等一求abc(过程)(1)a比b=5比3,b比c=2比3(2)a比b=0.4比0.5,b比 2020-07-30 …
设有定义:inta=4,b=5,c=6;以下语句中执行效果与其他三个不同的是()。设有定义:inta 2020-12-15 …
因式分解:(a+b+c)^5-a^5-b^5-c^5可以知道:a+b=0时,原式=0,但是为什么有( 2021-01-07 …