早教吧作业答案频道 -->化学-->
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是和.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.(1)写
题目详情
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是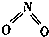 和
和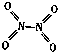 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
(1)写出N2O4转化NO2为的热化学方程式___.
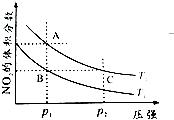
(2)对反应N2O4(g)⇌2NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.
①A、C两点的反应速率v(A)___v(C)(填“>”“=”或“<”).
②B、C两点的气体平均相对分子质量M(B)___M(C)(填“>”、“=”或“<”).
③由状态B到达状态A可用的方法是___.
④A点气体的颜色比C点___(填“深”、“浅”或“相同”),原因是___.
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据.
①在上述条件下,从反应开始直至20s时,v(NO2)=___mol•L-1•s-1.
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度应是___ mol•L-1.
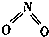 和
和 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
(1)写出N2O4转化NO2为的热化学方程式___.
(2)对反应N2O4(g)⇌2NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.
①A、C两点的反应速率v(A)___v(C)(填“>”“=”或“<”).
②B、C两点的气体平均相对分子质量M(B)___M(C)(填“>”、“=”或“<”).
③由状态B到达状态A可用的方法是___.
④A点气体的颜色比C点___(填“深”、“浅”或“相同”),原因是___.
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度应是___ mol•L-1.
▼优质解答
答案和解析
(1)根据化学反应的反应热=反应物的总键能-生成物的总键能,所以N2O4(g)⇌2NO2(g)的反应热△H=438.5 kJ•mol-1×4+167kJ•mol-1-466 kJ•mol-1×4=+57 Kj,•mol-1,所以N2O4转化为NO2的热化学方程式为:N2O4(g)⇌2NO2(g)△H=+57 kJ•mol-1,
故答案为:N2O4(g)⇌2NO2(g)△H=+57 kJ•mol-1;
(2)①C点压强大于A点,所以C点的反应速率快,即:v(A)②B、C两点的二氧化氮体积分数相同,为等效平衡,则气体的平均相对分子质量相同,即:M(B=M(C),故答案为:=;
③B的二氧化氮体积分数小于A点,该反应是吸热反应,温度升高,平衡正向移动,二氧化氮的体积分数增大,所以T2>T1,A、B压强相同,则由状态B到状态A,可以用加热的方法,
故答案为:加热;
④A、C点温度相同,C的压强增大,体积缩小,气体颜色加深,尽管平衡逆向移动,但最终气体的颜色比原平衡时深,则A浅、C深,即:A点气体的颜色比C点浅,
故答案为:浅;A点到C点时压强增大,即体积减小,平衡逆移,NO2的体积分数减小,但平衡时C点c(NO2)比A点大;
(3)①在上述条件下,该反应为2NO2(g)⇌N2O4(g),从反应开始直至20 s时,N2O4(g)的物质的量增加0.05mol,则二氧化氮的物质的量减少0.1mol,浓度减少
=0.05mol/L,二氧化氮的平均反应速率为:
=0.0025mol•(L•s)-1,
故答案为:0.0025;
②若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,即为等效平衡状态,则将0.4mol的二氧化氮完全转化为四氧化二氮的物质的量是0.2mol,则四氧化二氮的起始浓度为:
=0.10mol/L,
故答案为:0.10.
故答案为:N2O4(g)⇌2NO2(g)△H=+57 kJ•mol-1;
(2)①C点压强大于A点,所以C点的反应速率快,即:v(A)
③B的二氧化氮体积分数小于A点,该反应是吸热反应,温度升高,平衡正向移动,二氧化氮的体积分数增大,所以T2>T1,A、B压强相同,则由状态B到状态A,可以用加热的方法,
故答案为:加热;
④A、C点温度相同,C的压强增大,体积缩小,气体颜色加深,尽管平衡逆向移动,但最终气体的颜色比原平衡时深,则A浅、C深,即:A点气体的颜色比C点浅,
故答案为:浅;A点到C点时压强增大,即体积减小,平衡逆移,NO2的体积分数减小,但平衡时C点c(NO2)比A点大;
(3)①在上述条件下,该反应为2NO2(g)⇌N2O4(g),从反应开始直至20 s时,N2O4(g)的物质的量增加0.05mol,则二氧化氮的物质的量减少0.1mol,浓度减少
| 0.1mol |
| 2L |
| 0.05mol/L |
| 20s |
故答案为:0.0025;
②若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,即为等效平衡状态,则将0.4mol的二氧化氮完全转化为四氧化二氮的物质的量是0.2mol,则四氧化二氮的起始浓度为:
| 0.20mol |
| 2L |
故答案为:0.10.
看了 氮可形成多种气态氧化物,如N...的网友还看了以下:
一道数学题,有关log的如果log(下标8)3=k,请用K来表示log(下标8)18log(8) 2020-05-17 …
我给自己起了一个P.O.K的名字、想请英语好的高手帮我把p.o.k用英文一句话连起来取头一个字母, 2020-06-02 …
波矢处于|k|~|k|+d|k|区间的体积为(1/8)4PI|k|*|k|*d|k|,前面1/8怎 2020-07-02 …
用竖式计算,并验算.①6.8÷o.h②4.6÷1.h③h.4÷o.18④h.h8÷8.6⑤h.98 2020-07-29 …
在平面直角坐标系中,点O为原点,直线y=kx+4交x轴于点A,交y轴于点B,若△AOB的面积为8, 2020-07-30 …
已知直线l的斜率为√3,直线m的倾斜角是直线l的两倍,求直线m的斜率已知△ABC三个顶点分别为A( 2020-07-30 …
若关于x的方程x-7分之x-8-7-x分之k=8有增根,则k=.(x-7)/(x-8)-(7-x) 2020-07-31 …
如图,直线AB经过原点O,与双曲线y=kx(k≠0)交于A、B两点,AC⊥y轴于点C,且△ABC的面 2020-11-01 …
高中原子结构的题H;O;K形成的化合物中存在的化学键有 2020-11-28 …
已知K=1.4×10-5,K=1.8×10-10,K=1.1×10-10,将等体积的0.0020mo 2021-01-09 …