如图所示,在烧杯A中盛有20℃,50mL水,B中盛有1mol×L-1盐酸50mL,试管C、D相通,其中盛有红棕色气体,它处于下列平衡状态,2NO2N2O4(
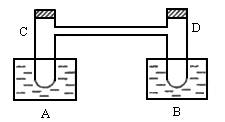
( 1 ) A 、 B 的烧杯中, A 杯溶液温度 ________ , B 杯溶液温度 ________ 。
( 2 ) A 杯中溶液的 pH________7 , B 杯中溶液的 pH________7 。
( 3 )试管 C 中气体颜色变 ________ , D 中气体颜色变 ________ 。
( 4 )在 20 ℃时,硝酸铵的溶解度为 197g ,则推知: A 中的溶液 ________ 达饱和。
( 5 )烧杯 B 中,全部物质完全反应后,理论上可放热应大于 ________kJ
4亿+用户的选择


扫二维码下载作业帮
解析:
(1)降低 升高 (2)< = (3)浅 深 (4)未 (5)2.89
提示:
提示:
(1)A中NH4NO3溶解时吸热,所以溶液温度降低,B中苛性钠与盐酸中和放热可使溶液的温度升高。 (2)A中NH4NO3为强酸弱碱盐,水解后呈酸性pH<7,B中盐酸恰好与加入的2g苛性钠完全反应生成NaCl,溶液pH=7。 (3)C试管温度降低,使2NO2N2O4平衡正向移动,气体颜色应变浅,D中升温化学平衡逆向移动,气体颜色加深。 (4)根据溶解度计算:设50mL水溶解xg硝酸铵达饱和,则x∶50=197∶100,解得x=98.5g,所以A为不饱和溶液。 (5)由于强酸强碱的中和热是57.8kJ×mol-1,2g苛性钠相当于0.05mol,与等量盐酸反应放出:0.05mol´57.8kJ×mol-1=2.89kJ热量,而苛性钠固体溶解时又可放出热量,所以实际放出热量大于2.89kJ。
A=zeros(2,5); A(:)=-4:5 L=abs(A)>3 islogical(L) X 2020-05-16 …
已知三角形的三个顶点A(1,1),B(5,3),C(4,5),l平行于AB且平分三角形ABC的面积 2020-06-04 …
有编号1,2,3,4,5,的茶杯和编号为1,2,3,4,5的5个杯盖,将5个杯盖盖在杯上,至少有两 2020-06-12 …
有5只杯子杯口朝下盖在桌子上每次翻动其中4只,能否经过若干次翻动,使杯口全部朝上?有5只杯子杯口朝 2020-07-04 …
妈妈用橙汁和水调制了几杯饮料,第一杯橙汁和水的体积比是3比4,第二杯是5比12,第三杯是4比5,第 2020-07-13 …
大、中、小三种杯子,2大杯相当于5中杯,3中杯相当于4小杯,如果记号①2大杯、3中杯、4小杯容量之 2020-07-29 …
另一道高中不等关系与不等式题目4个茶杯和5包茶叶的总价小于22元,而6个茶杯和3包茶叶的总价大于2 2020-08-01 …
2.5有理数加法减法混合运算计算:(1)7+4-5(2)-5-3-9+7+三分之二(3)-10-12 2020-12-17 …
你帮我回答的化简函数很厉害,你还可以帮我化简几道题吗?用卡诺图法化简1题L=∑m(0,1,3,5,7 2020-12-23 …
1.桌子上有7只茶杯,杯口都朝上,每次将其中4只茶杯同时翻转,能否经过很多次翻转,使全部杯口朝下?2 2020-12-31 …