早教吧作业答案频道 -->化学-->
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:(1)A点水的离子积为1×10-14,B点水的离子积为.造成水的离子积变化的原因是(2)100℃时,若向溶液中滴加盐酸,能否使体
题目详情
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
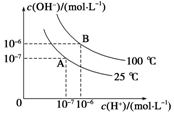
(1)A点水的离子积为1×10-14,B点水的离子积为___.
造成水的离子积变化的原因是___
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?
___.
(3)100℃时,若盐酸中c(H+)=5×10-4 mol•L-1,则由水电离产生的c(H+)是多少?

(1)A点水的离子积为1×10-14,B点水的离子积为___.
造成水的离子积变化的原因是___
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?
___.
(3)100℃时,若盐酸中c(H+)=5×10-4 mol•L-1,则由水电离产生的c(H+)是多少?
▼优质解答
答案和解析
我 (1)水的电离过程是吸热的,B曲线相当于A曲线在升高温度,则水的电离程度增大,促进电离,所以氢离子和氢氧根离子浓度增大,B曲线下,Kw=C(H+)•c(OH-)=1.0×10-12mol2/L2,水的离子积增大,
故答案为:1×10-12;水的电离过程是吸热的,升高温度,水的电离程度增大,即水的离子积会增大;
(2)向溶液中滴加盐酸会对水的电离起到抑制作用,氢离子浓度增大,氢氧根浓度减小,但是温度不变,水的离子积不变,所以体系不会处于B点位置,会在该温度曲线的基础上向着下方移动,
答:不会;氢离子浓度增大,氢氧根浓度减小,但是温度不变,水的离子积不变;
(3)根据溶液中Kw=c(H+)•c(OH-),100℃时,若盐酸中[H+]=5×10-4mol•L-1,则水电离出的c(H+)=c(OH-)=
mol/L=2×10-9mol/L.
答:由水电离产生的[H+]是2×10-9mol/L.
故答案为:1×10-12;水的电离过程是吸热的,升高温度,水的电离程度增大,即水的离子积会增大;
(2)向溶液中滴加盐酸会对水的电离起到抑制作用,氢离子浓度增大,氢氧根浓度减小,但是温度不变,水的离子积不变,所以体系不会处于B点位置,会在该温度曲线的基础上向着下方移动,
答:不会;氢离子浓度增大,氢氧根浓度减小,但是温度不变,水的离子积不变;
(3)根据溶液中Kw=c(H+)•c(OH-),100℃时,若盐酸中[H+]=5×10-4mol•L-1,则水电离出的c(H+)=c(OH-)=
| 10-12 |
| 5×10-4 |
答:由水电离产生的[H+]是2×10-9mol/L.
看了 在水的电离平衡中,c(H+)...的网友还看了以下:
下列关于1的叙述中,正确的有()(1)是最小的自然数(2)1是最小的正整数(3)1是任何正整数的因数 2020-03-30 …
已知关于x的方程x2+ax+b=0(b≠0),若a+b=-2,称a与b关于-1的平衡数,称这类方程 2020-05-23 …
n阶实对称方阵A的n个互不相同的特征值为λ1..λn,ξ1是A关于λ1的单位特征向量,求B=A-λ 2020-06-22 …
关于一个极限的数学公式当limf(x)^g(x)=e^j,为什么其中J=limg(x)[f(x)- 2020-07-20 …
定义:若a+b=2,则称a与b是关于1的平衡数,5-x与()是关于1的平衡数若a=a=2x²-3(x 2020-11-02 …
有关造句的(赏10分)用:蓦然回首·茫然若失·沉淀·书垛·摒弃·束缚·伏案·犀利·怪僻·墙橹·古朴· 2020-11-26 …
2008年北京奥运会开幕式之际,张艺谋和他的团队,选择了一张巨大的画轴,向世界呈现了一幅中国的长卷、 2020-12-09 …
2008年北京奥运会开幕式之际,张艺谋和他的团队,选择了一张巨大的画轴,向世界呈现了一幅中国的长卷、 2020-12-09 …
若a+b=2则称a与b是关于1的平衡数如6+(-4)=2则6与-4是关于1的平衡数1.3与()是关于 2020-12-15 …
下列各句中,没有语病的一句是:()A.海外华人参政意识不强,跟欧美白人甚至非裔相比,华人不太擅长公共 2020-12-18 …