早教吧作业答案频道 -->化学-->
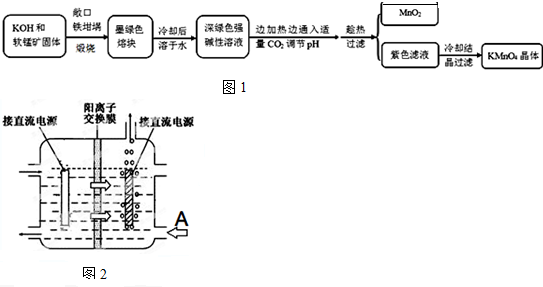
高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].图1是实验室模拟制备的操作流程:相关资料:①物质溶解度物
题目详情
高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].图1是实验室模拟制备的操作流程:
相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是___;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:___;
其中氧化还原反应中氧化剂和还原剂的质量比为___.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中___,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式___提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图).图2中A口加入的溶液最好为___.使用阳离子交换膜可以提高Mn元素利用率的原因为___.4224

物质 KMnO4 K2CO3 KHCO3 K2SO4 CH3COOK 20℃溶解度 6.4 111 33.7 11.1 217 物质 KMnO4 K2CO3 KHCO3 K2SO4 CH3COOK 物质 KMnO4 4K2CO3 23KHCO3 3K2SO4 24CH3COOK 3 20℃溶解度 6.4 111 33.7 11.1 217 20℃溶解度 6.4 111 33.7 11.1 217 24
42-
42-
2342
22

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是___;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:___;
其中氧化还原反应中氧化剂和还原剂的质量比为___.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中___,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式___提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图).图2中A口加入的溶液最好为___.使用阳离子交换膜可以提高Mn元素利用率的原因为___.4224

| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
42-
42-
2342
22
▼优质解答
答案和解析
(1)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀,加热软锰矿和KOH固体时,不采用瓷坩埚而选用铁坩埚,
故答案为:高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;
(2)工艺流程可知,CO22使MnO442-2-发生歧化反应,生成MnO44--和MnO22,根据元素守恒可知,会生成K22CO33,若通入CO22太多,会生KHCO33,滤液中含有KHCO33、KMnO44,在加热浓缩时,会有KHCO33晶体和KMnO44晶体一起析出,实验中通入适量CO22时体系中可能发生反应离子方程式为:3MnO442-2-+2CO22═2MnO44--+MnO22↓+2CO332-2-,2OH--+CO22═CO332-2-+H22O,其中氧化还原反应中氧化剂和还原剂都是高锰酸钾,所以氧化剂和还原剂的质量比即为反应的物质的量之比为1:2;
故答案为:3MnO442-2-+2CO22═2MnO44--+MnO22↓+2CO332-2-,2OH--+CO22═CO332-2-+H22O;1:2;
(3)因为盐酸具有还原性,易被高锰酸钾氧化,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时基本上都会留在母液中,硫酸加入生成的硫酸钾溶解度小,会随KMnO44一起结晶析出得到的高锰酸钾中含有杂质;
故答案为:A;
(4)惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中氢离子在阴极得到电子生成氢气,溶液中氢氧根离子浓度增大生成碱,电解反应的化学方程式为:2K22MnO44+2H22O
2KMnO4+H2↑+2KOH,阳离子交换膜分隔两极区进行电解锰酸钾溶液制取高锰酸钾,阳离子移向方向可知左边电极为阳极,右边冒气泡的电极为阴极,为维持电解质溶液电荷守恒,A处最好加入氢氧化钾溶液,使用阳离子交换膜可以提高Mn元素利用率是因为阳离子交换膜防止锰酸根进入阴极区被还原;
故答案为:2K2MnO4+2H2O
2KMnO4+H2↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
通电 通电 通电 通电 2KMnO44+H22↑+2KOH,阳离子交换膜分隔两极区进行电解锰酸钾溶液制取高锰酸钾,阳离子移向方向可知左边电极为阳极,右边冒气泡的电极为阴极,为维持电解质溶液电荷守恒,A处最好加入氢氧化钾溶液,使用阳离子交换膜可以提高Mn元素利用率是因为阳离子交换膜防止锰酸根进入阴极区被还原;
故答案为:2K22MnO44+2H22O
2KMnO4+H2↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
通电 通电 通电 通电 2KMnO44+H22↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
故答案为:高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;
(2)工艺流程可知,CO22使MnO442-2-发生歧化反应,生成MnO44--和MnO22,根据元素守恒可知,会生成K22CO33,若通入CO22太多,会生KHCO33,滤液中含有KHCO33、KMnO44,在加热浓缩时,会有KHCO33晶体和KMnO44晶体一起析出,实验中通入适量CO22时体系中可能发生反应离子方程式为:3MnO442-2-+2CO22═2MnO44--+MnO22↓+2CO332-2-,2OH--+CO22═CO332-2-+H22O,其中氧化还原反应中氧化剂和还原剂都是高锰酸钾,所以氧化剂和还原剂的质量比即为反应的物质的量之比为1:2;
故答案为:3MnO442-2-+2CO22═2MnO44--+MnO22↓+2CO332-2-,2OH--+CO22═CO332-2-+H22O;1:2;
(3)因为盐酸具有还原性,易被高锰酸钾氧化,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时基本上都会留在母液中,硫酸加入生成的硫酸钾溶解度小,会随KMnO44一起结晶析出得到的高锰酸钾中含有杂质;
故答案为:A;
(4)惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中氢离子在阴极得到电子生成氢气,溶液中氢氧根离子浓度增大生成碱,电解反应的化学方程式为:2K22MnO44+2H22O
| ||
故答案为:2K2MnO4+2H2O
| ||
| ||
| 通电 |
. |
| 通电 |
. |
| 通电 |
. |
| 通电 |
. |
.
.
.
.
.故答案为:2K22MnO44+2H22O
| ||
| ||
| 通电 |
. |
| 通电 |
. |
| 通电 |
. |
| 通电 |
. |
.
.
.
.
.
看了 高锰酸钾[KMnO4]是常用...的网友还看了以下:
1.已知某DNA分子含有1000个碱基对,其中一条链上A:G:T:C=1:2:3:4,该DNA分子 2020-05-14 …
某学校高一年级学生某次身体素质体能测试的原始成绩采用百分制,已知所有这些学生的原始成绩均分布在[5 2020-05-15 …
某学校高一年级学生某次身体素质体能测试的原始成绩采用百分制,已知所有这些学生的原始成绩均分布在[5 2020-05-15 …
抗战时期,陕甘宁边区政府发扬民主、健全法制,制定了施政纲领、刑事法规、土地民事法规、婚姻法规、诉讼 2020-06-21 …
11个队参赛,请你用单淘汰制和单循环制分别编排出他们的比赛轮次表。11个队参赛,请你用单淘汰制和单 2020-07-03 …
制表析史制作历史表格,不仅能将复杂的历史知识化繁为简,而且有助于我们更好地分析与理解历史问题。(1 2020-07-04 …
1.按控制点的不同时间分类,可把控制分为()A.预先控制B.持续控制C.现场控制D.事后控制满分:5 2020-11-01 …
中考最后26天有什么方法可以提高语文我两颗都在90分左右150分制英语40+我已经放弃了90+90+ 2020-11-24 …
根据政治权力受限制的程度,把君主制分为()。A.世袭制政体B.绝对君主制C.选任政体D.有限君主制E 2020-12-22 …
当前,世情、国情、党情发生深刻变化,我国发展中不平衡、不协调、不可持续问题突出,制约科学发展昀体制机 2020-12-22 …