早教吧作业答案频道 -->化学-->
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)水电解反应:2H2O(l)电解
题目详情
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
水电解反应:2H2O(l)
2H2(g)+O2(g)
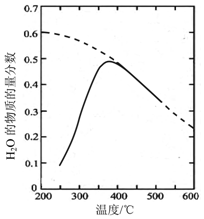
(1)将原料气按n(CO2):nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线).
①该反应的平衡常数K随温度升高而___(填“增大”或“减小”).
②温度过高或过低均不利于该反应的进行,原因是___.
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为___.(不必化简.用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是___(填标号).
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)⇌C(s)+2H2O(g)代替Sabatier反应.
①已知CO2(g)、H2O(g)的生成焓分别为-394kJ•mol-1、-242kJ•mol-1,Bosch反应的△H=___kJ•mol-1.(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
②一定条件下Bosch反应必须在高温下才能启动,原因是___.
③新方案的优点是___.
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
水电解反应:2H2O(l)
| ||

(1)将原料气按n(CO2):nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线).
①该反应的平衡常数K随温度升高而___(填“增大”或“减小”).
②温度过高或过低均不利于该反应的进行,原因是___.
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为___.(不必化简.用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是___(填标号).
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)⇌C(s)+2H2O(g)代替Sabatier反应.
①已知CO2(g)、H2O(g)的生成焓分别为-394kJ•mol-1、-242kJ•mol-1,Bosch反应的△H=___kJ•mol-1.(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
②一定条件下Bosch反应必须在高温下才能启动,原因是___.
③新方案的优点是___.
▼优质解答
答案和解析
(1)①根据图知,当反应达到平衡状态后,升高温度,水的物质的量分数减小,说明平衡逆向移动,则生成物浓度减小、反应物浓度增大,所以化学平衡常数减小,故答案为:减小;
②温度过低,化学反应速率小;温度过高,平衡逆向移动,反应向右进行的程度减小,所以温度过高或过低均不利于该反应的进行,
故答案为:温度过低,反应速率小;温度过高,反应向右进行的程度小;
③设开始时n(CO2)为1mol、n(H2)=4mol,
设参加反应的n(CO2)为xmol,
该反应方程式CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
开始(mol)1 4 0 0
反应(mol)x 4x x 2x
平衡(mol)1-x 4-4x x 2x
水蒸气的物质的量分数=
=0.6,x=
P(CO2)=P×
=0.02P、P(H2)=
×P=0.08P、P(CH4)=
×P=0.3P、P(H2O)=
×P=0.6P,
压强平衡常数K=
=
,
故答案为:
;
(2)A.适当减压,平衡逆向移动,二氧化碳转化率减小,故A错误;
B.增大催化剂的比表面积,反应物浓度增大,平衡正向移动,二氧化碳转化率增大,故B正确;
C.反应器前段加热,后段冷却,平衡正向移动,二氧化碳转化率增大,故C正确;
D.提高原料气中CO2所占比例,平衡正向移动,但二氧化碳转化率减小,故D错误;
E.合理控制反应器中气体的流速,相当于增大浓度,平衡正向移动,二氧化碳转化率增大,故E正确;
故选BCE;
(3)①Bosch反应的△H=2(-242kJ•mol-1)-(-394kJ•mol-1)=-90kJ/mol,
故答案为:-90;
②断裂二氧化碳和氢气所需的能量较高,所以该反应所需的活化能较高,则一定条件下Bosch反应必须在高温下才能启动,故答案为:反应的活化能高;
③该反应中氢元素完全转化为水,氢原子利用率为100%,
故答案为:氢原子利用率为100%.
②温度过低,化学反应速率小;温度过高,平衡逆向移动,反应向右进行的程度减小,所以温度过高或过低均不利于该反应的进行,
故答案为:温度过低,反应速率小;温度过高,反应向右进行的程度小;
③设开始时n(CO2)为1mol、n(H2)=4mol,
设参加反应的n(CO2)为xmol,
该反应方程式CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
开始(mol)1 4 0 0
反应(mol)x 4x x 2x
平衡(mol)1-x 4-4x x 2x
水蒸气的物质的量分数=
| 2x |
| 1-x+4-4x+x+2x |
| 15 |
| 16 |
P(CO2)=P×
1-
| ||
5-2×
|
4×(1-
| ||
5-2×
|
| ||
5-2×
|
2×
| ||
2-5×
|
压强平衡常数K=
| P(CH4).P2(H2O) |
| P(CO2).P4(H2) |
| 0.3P×(0.6P)2 |
| 0.02P×(0.08P)4 |
故答案为:
| 0.3P×(0.6P)2 |
| 0.02P×(0.08P)4 |
(2)A.适当减压,平衡逆向移动,二氧化碳转化率减小,故A错误;
B.增大催化剂的比表面积,反应物浓度增大,平衡正向移动,二氧化碳转化率增大,故B正确;
C.反应器前段加热,后段冷却,平衡正向移动,二氧化碳转化率增大,故C正确;
D.提高原料气中CO2所占比例,平衡正向移动,但二氧化碳转化率减小,故D错误;
E.合理控制反应器中气体的流速,相当于增大浓度,平衡正向移动,二氧化碳转化率增大,故E正确;
故选BCE;
(3)①Bosch反应的△H=2(-242kJ•mol-1)-(-394kJ•mol-1)=-90kJ/mol,
故答案为:-90;
②断裂二氧化碳和氢气所需的能量较高,所以该反应所需的活化能较高,则一定条件下Bosch反应必须在高温下才能启动,故答案为:反应的活化能高;
③该反应中氢元素完全转化为水,氢原子利用率为100%,
故答案为:氢原子利用率为100%.
看了 航天员呼吸产生的CO2用下列...的网友还看了以下:
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g) 2020-04-11 …
已知下列热化学方程式:Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g);△H="-24. 2020-05-13 …
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/molFe2O3 2020-05-14 …
读图完成下列问题(1)写出下列字母代表的地理事物:A洲,B洲,C洋,D洋,E洋,F海峡,G站,H站 2020-05-14 …
已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) ( 可逆)CO2(g)+H2(g)CO(g 2020-05-16 …
在一定温度下,将CO和水蒸气2mol放在密闭容器内,反应co(g)+H2O(g)=(可逆)CO2( 2020-05-16 …
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳.该电池负极发生的反应是A 2020-05-17 …
以知反应eO(s)+Co(g)=Fe(s)+Co2(g)的K=0.5(1273K).若起始浓度c( 2020-07-21 …
对于反应CO2(g)+4H2(g)=CH4(g)+2H2O(g),已经算出来了1000K时的标准平 2020-07-22 …
已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)(可逆)CO2(g)+H2(g)K°=Kp*( 2021-02-04 …