早教吧作业答案频道 -->化学-->
实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.制备KClO及K2FeO4(1)
题目详情
实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
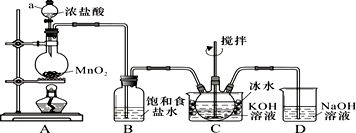
已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是___.
(2)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为___.再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,
②___,
③___,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由___
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为:___.
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为:___.
计算该K2FeO4样品的纯度为___.

已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是___.
(2)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为___.再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,
②___,
③___,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由___
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为:___.
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为:___.
计算该K2FeO4样品的纯度为___.
▼优质解答
答案和解析
根据实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,氯气中有挥发出的来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,为防止在较高温度下生成KClO3,C装置中用冰水浴,反应的尾气氯气用D装置中氢氧化钠吸收,
(1)Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以冰水浴的目的是防止Cl2与KOH反应生成KClO3,
故答案为:防止Cl2与KOH反应生成KClO3;
(2)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O;
(3)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,因K2FeO4易溶于水,防止用水洗涤时晶体溶解会损失,改用乙醇洗涤2~3次,⑤在真空干燥箱中干燥,
故答案为:过滤;将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;K2FeO4易溶于水,防止用水洗涤时晶体损失;
(4)因滤液中存在CrO42-+2H+⇌H2O+Cr2O72-之间的转化,添加强酸促进平衡向正方向移动,提高溶液里Cr2O72-的浓度,故答案为:CrO42-+2H+⇌H2O+Cr2O72-;
(5)滴定时Cr2O72-在酸性条件下氧化溶液里的Fe2+时发生反应的离子反应方程式为:Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O;根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,根据题意可知,(NH4)2Fe(SO4)2的物质的量为0.03L×0.01000 mol/L=0.0003mol,所以高铁酸钾的质量为0.0003mol×
×198g/mol×
=0.198g,所以K2FeO4样品的纯度
×100%=94.3%,
故答案为:Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O;94.3%.
(1)Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以冰水浴的目的是防止Cl2与KOH反应生成KClO3,
故答案为:防止Cl2与KOH反应生成KClO3;
(2)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O;
(3)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,因K2FeO4易溶于水,防止用水洗涤时晶体溶解会损失,改用乙醇洗涤2~3次,⑤在真空干燥箱中干燥,
故答案为:过滤;将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;K2FeO4易溶于水,防止用水洗涤时晶体损失;
(4)因滤液中存在CrO42-+2H+⇌H2O+Cr2O72-之间的转化,添加强酸促进平衡向正方向移动,提高溶液里Cr2O72-的浓度,故答案为:CrO42-+2H+⇌H2O+Cr2O72-;
(5)滴定时Cr2O72-在酸性条件下氧化溶液里的Fe2+时发生反应的离子反应方程式为:Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O;根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,根据题意可知,(NH4)2Fe(SO4)2的物质的量为0.03L×0.01000 mol/L=0.0003mol,所以高铁酸钾的质量为0.0003mol×
| 1 |
| 3 |
| 250mL |
| 25mL |
| 0.198g |
| 0.2100g |
故答案为:Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O;94.3%.
看了 实验室用如图所示装置制备KC...的网友还看了以下:
用给定的五种元素:Cu、O、H、Ba、N,写出符合要求的物质化学式:(1)可溶性碱.(2)水溶液呈 2020-04-11 …
1.描述下列实验现象,并列出相应的化学反应方程式:向过量AgNO3溶液中滴入少量Na2S2O3溶液 2020-05-14 …
二、简答题:1.临床为病人大量输液时,为什么要用等渗溶液?2.影响化学反应速率的因素有哪些?怎样解 2020-06-11 …
(2p12•聊城一模)如2是o体屈肘时肌肉的协作示意2.请根据2回答:(1)2中a是,当o屈肘时, 2020-06-28 …
1mol/LBa(OH)2溶液的含义是[]A.1L水中含有1molBa(OH)2B.1L溶液中含有 2020-07-18 …
(2003•温州)如图1,点A在⊙O外,射线AO交⊙O于F,C两点,点H在⊙O上,=2,D是上的一 2020-07-19 …
数学圆的切线1.如图,在三角形ABC中,角BCA=90度,角A=30度,以AB为直径画圆O,延长A 2020-07-31 …
A1.NaOH溶液2.稀硫酸生成B和C.B在浓硫酸加热条件下生成D,D在一定条件生成E.已知:①A的 2020-10-31 …
读北美0℃等温线分布图,回答问题。小题1:此图季节是A.春季B.夏季C.秋季D.冬季小题2:请从高到 2020-12-07 …
下列示意图与对应的反应情况正确的是()A.含0.01molKOH和0.01molCa(OH)2的混合 2021-02-09 …