早教吧作业答案频道 -->化学-->
减少CO2的排放以及CO2的资源化利用具有重要意义.(1)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.①写出氨水捕集烟气中的CO2生成铵盐的主要化学方程式.②分别用
题目详情
减少CO2的排放以及CO2的资源化利用具有重要意义.
(1)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成铵盐的主要化学方程式___.
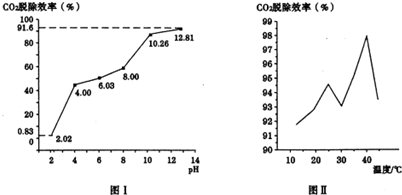
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图Ⅰ所示,CO2脱除效率与吸收剂的pH关系是___.烟气中CO2的含量为12%,烟气通人氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量为___(精确到0.01).
③CO2脱除效率与温度的关系如图Ⅱ所示.从40℃到45℃脱除CO2效率降低的主要原因是___.
(2)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为
2H2(g)+CO(g)⇌CH3OH(g)△H=-90.1kJ/mol.
①在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投人反应物,测得反应达到平衡时的有关数据如下.
下列说法正确的是___(填字母編号).
A.2c1>c3 B.|x|+|y|<90.1 C.2p2<p3 D.a1+a3<1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若甲容器中反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数为___(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).
(1)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成铵盐的主要化学方程式___.
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图Ⅰ所示,CO2脱除效率与吸收剂的pH关系是___.烟气中CO2的含量为12%,烟气通人氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量为___(精确到0.01).
③CO2脱除效率与温度的关系如图Ⅱ所示.从40℃到45℃脱除CO2效率降低的主要原因是___.
(2)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为
2H2(g)+CO(g)⇌CH3OH(g)△H=-90.1kJ/mol.
①在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投人反应物,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.|x|+|y|<90.1 C.2p2<p3 D.a1+a3<1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若甲容器中反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数为___(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).

▼优质解答
答案和解析
(1)①氨水与CO2反应生成碳酸氢铵,反应的方程式为CO2+NH3•H2O═NH4HCO3;故答案为:CO2+NH3•H2O═NH4HCO3;
②根据图1分析,CO2脱除效率随吸收剂的pH增大而增大;因为烟气通人氨水的流量为0.052m3/h(标准状况),所以30min通入的烟气中含二氧化碳体积为0.052m3/h×0.5h×12%=0.00312m3,则物质的量为
=0.14mol,故答案为:CO2脱除效率随吸收剂的pH增大而增大;0.14mol;
③因为温度高生成的碳酸氢铵易分解生成二氧化碳,所以从40℃到45℃脱除CO2效率降低,故答案为:碳酸氢铵受热易分解生成二氧化碳;
(2)①A、甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2c1<c3,故A错误;
B、由题目可知生成1molCH3OH的能量变化为90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1-n),故a+b=90.8,故B错误;
C、比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2p2>p3,故C错误;
D、甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,所以a1+a3<1,故D正确,
故选D;
②由 2H2(g)+CO(g)⇌CH3OH(g)起始反应物投入量2mol H2、l mol CO,设开始时氢气压强为2P,CO压强为P,
开始(kPa) 2P P 0
转化(kPa)48.0 24.0 24.0
平衡(kPa)2P-48 P-24 24
Kp=
=6.0×10-3(kPa)-2,解得P=34.0kPa,则平衡混合气体中CH3OH的物质的量分数为
=
×100%=44.4%,故答案为:44.4%;
②根据图1分析,CO2脱除效率随吸收剂的pH增大而增大;因为烟气通人氨水的流量为0.052m3/h(标准状况),所以30min通入的烟气中含二氧化碳体积为0.052m3/h×0.5h×12%=0.00312m3,则物质的量为
| 0.00312×10 3L |
| 22.4L/mol |
③因为温度高生成的碳酸氢铵易分解生成二氧化碳,所以从40℃到45℃脱除CO2效率降低,故答案为:碳酸氢铵受热易分解生成二氧化碳;
(2)①A、甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2c1<c3,故A错误;
B、由题目可知生成1molCH3OH的能量变化为90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1-n),故a+b=90.8,故B错误;
C、比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2p2>p3,故C错误;
D、甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,所以a1+a3<1,故D正确,
故选D;
②由 2H2(g)+CO(g)⇌CH3OH(g)起始反应物投入量2mol H2、l mol CO,设开始时氢气压强为2P,CO压强为P,
开始(kPa) 2P P 0
转化(kPa)48.0 24.0 24.0
平衡(kPa)2P-48 P-24 24
Kp=
| 24 |
| (2P-48) 2×(P-24) |
| 分压 |
| 总压 |
| 24 |
| 30+24 |
看了 减少CO2的排放以及CO2的...的网友还看了以下:
对权利与义务的关系理解正确的是A.在享有权利的同时,要自觉履行义务B.对于未成年人,只有权利,没有 2020-04-08 …
定义在R上的函数f(x),对任意x,y∈R,有f(x+y)+f(x-y)=2f(x)*f(y),且 2020-05-13 …
A.根据释义,拼写单词.1.costingalotofmoneyx,p,s,i,e,e,e,n,v 2020-06-10 …
酯的写法,比如R1-O-C(=O)-R2与R1-C(=O)-O-R2,有什么区别啊,核磁图有什么不 2020-06-24 …
选择:诺a>b>o,c<d<o,则一定有()A,c分之a>d分之bB,c分之a<d分之b选择:诺a 2020-06-29 …
下列生物体中有关物质的叙述,错误的是()A、叶绿素分子含有元素C、H、O、N、MgB、血红蛋白分子 2020-07-13 …
如图,有点O,O'和三角形ABC三角形A'B'C',满足下列条件:向量OA=a向量,向量OB=b向 2020-08-01 …
下列生物体中有关物质的叙述,错误的是()A.叶绿素分子含有元素C、H、O、N、MgB.血红蛋白分子含 2020-12-02 …
下列词语中加点字的读音全对的一项是()。A.褒(bǎo)义汲(jí)黯恬(tiān)退隐忍宫阙(qu 2020-12-26 …
生活在社区里,作为社区的一员,我们[]A.既有权利又有义务B.只有权利没有义务C.只有义务没有权利D 2021-02-15 …