早教吧作业答案频道 -->化学-->
某小组模拟工业合成氨,并制备NaHCO3,设计实验如下(夹持装置略去).回答下列问题:(1)装置E中盛放碱石灰的仪器名称为.(2)装置A中发生反应的离子方程式为.(3)装置C的作
题目详情
某小组模拟工业合成氨,并制备NaHCO3,设计实验如下(夹持装置略去).
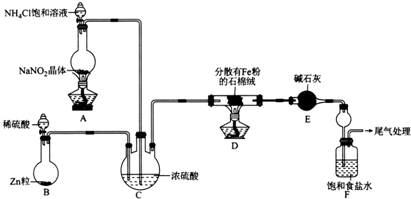
回答下列问题:
(1)装置E中盛放碱石灰的仪器名称为___.
(2)装置A中发生反应的离子方程式为___.
(3)装置C的作用为使N2和H2混合均匀___、___.
(4)实验时,应先打开装置B中分液漏斗活塞,反应一段时间,在装置末端导管处收集H2并验纯后,再点燃D处酒精灯,原因为___.
(5)当F中的氨气饱和后,取下装置F,再向其中通入足量CO2,现象为___;发生反应的离子方程式为___.
(6)已知:Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色,Ksp(Ag2CrO4)=1.2×10-12.该小组同学设计实验测定25℃时,NH4Cl饱和溶液的物质的量浓度.取NH4Cl饱和溶液10.00mL,于锥形瓶中,滴加2~3滴K2CrO4溶液;用2.000mol•L-1的AgNO3标准溶液滴定,重复滴定3次,平均消耗AgNO3溶液26.00mL.判断达到滴定终点的方法为___;NH4Cl饱和溶液的物质的量浓度为___.

回答下列问题:
(1)装置E中盛放碱石灰的仪器名称为___.
(2)装置A中发生反应的离子方程式为___.
(3)装置C的作用为使N2和H2混合均匀___、___.
(4)实验时,应先打开装置B中分液漏斗活塞,反应一段时间,在装置末端导管处收集H2并验纯后,再点燃D处酒精灯,原因为___.
(5)当F中的氨气饱和后,取下装置F,再向其中通入足量CO2,现象为___;发生反应的离子方程式为___.
(6)已知:Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色,Ksp(Ag2CrO4)=1.2×10-12.该小组同学设计实验测定25℃时,NH4Cl饱和溶液的物质的量浓度.取NH4Cl饱和溶液10.00mL,于锥形瓶中,滴加2~3滴K2CrO4溶液;用2.000mol•L-1的AgNO3标准溶液滴定,重复滴定3次,平均消耗AgNO3溶液26.00mL.判断达到滴定终点的方法为___;NH4Cl饱和溶液的物质的量浓度为___.
▼优质解答
答案和解析
(1)根据装置图可以知道装置E中盛放碱石灰的仪器名称为干燥管,故答案为:干燥管;
(2)根据图示,装置A的作用是制备氮气,氯化铵和亚硝酸钠之间的反应为:NO2-+NH4+
N2↑+2H2O,故答案为:NO2-+NH4+
N2↑+2H2O;
(3)装置D中氮气和氢气按照一定的比例混合可以得到氨气,装置C的作用为使N2和H2混合均匀、干燥氮气和氢气、通过气泡的溢出速率控制氮气和氢气的混合比例,故答案为:干燥氮气和氢气;通过气泡的溢出速率控制氮气和氢气的混合比例;
(4)实验时,应先打开装置B中分液漏斗活塞,反应一段时间,在装置末端导管处收集H2并验纯后,再点燃D处酒精灯,这样不但防止加热时空气中的氧气和水蒸气和金属铁反应使金属铁失去金属活性,还可以防止氢气和氧气混合加热爆炸,故答案为:防止加热时空气中的氧气和水蒸气和金属铁反应使金属铁失去金属活性;防止氢气和氧气混合加热爆炸;
(5)饱和氯化钠可以吸收氨气,得到碱性溶液,该溶液可以吸收二氧化碳气体,得到溶解度较小的碳酸氢钠晶体,即Na++CO2+NH3+H2O=NH4++HCO3-;
故答案为:白色的晶体析出;Na++CO2+NH3+H2O=NH4++HCO3-;
(6)根据溶度积常数的意义,知道先生成的是AgCl,再生成砖红色的铬酸银,可以确定滴定终点的现象是:滴入最后一滴硝酸银出现砖红色沉淀,半分钟内沉淀不消失,氯化铵饱和溶液的物质的量浓度是2mol/L×0.026L÷0.01L=5.2mol/L,故答案为:滴入最后一滴硝酸银出现砖红色沉淀,半分钟内沉淀不消失;5.2mol/L.
(2)根据图示,装置A的作用是制备氮气,氯化铵和亚硝酸钠之间的反应为:NO2-+NH4+
| ||
| ||
(3)装置D中氮气和氢气按照一定的比例混合可以得到氨气,装置C的作用为使N2和H2混合均匀、干燥氮气和氢气、通过气泡的溢出速率控制氮气和氢气的混合比例,故答案为:干燥氮气和氢气;通过气泡的溢出速率控制氮气和氢气的混合比例;
(4)实验时,应先打开装置B中分液漏斗活塞,反应一段时间,在装置末端导管处收集H2并验纯后,再点燃D处酒精灯,这样不但防止加热时空气中的氧气和水蒸气和金属铁反应使金属铁失去金属活性,还可以防止氢气和氧气混合加热爆炸,故答案为:防止加热时空气中的氧气和水蒸气和金属铁反应使金属铁失去金属活性;防止氢气和氧气混合加热爆炸;
(5)饱和氯化钠可以吸收氨气,得到碱性溶液,该溶液可以吸收二氧化碳气体,得到溶解度较小的碳酸氢钠晶体,即Na++CO2+NH3+H2O=NH4++HCO3-;
故答案为:白色的晶体析出;Na++CO2+NH3+H2O=NH4++HCO3-;
(6)根据溶度积常数的意义,知道先生成的是AgCl,再生成砖红色的铬酸银,可以确定滴定终点的现象是:滴入最后一滴硝酸银出现砖红色沉淀,半分钟内沉淀不消失,氯化铵饱和溶液的物质的量浓度是2mol/L×0.026L÷0.01L=5.2mol/L,故答案为:滴入最后一滴硝酸银出现砖红色沉淀,半分钟内沉淀不消失;5.2mol/L.
看了 某小组模拟工业合成氨,并制备...的网友还看了以下:
两位同学用下面两套装置探究酵母菌呼吸方式.实验装置均放在适宜环境中培养8~10h,两组装置中的石灰 2020-05-13 …
两位同学用下面两套装置探究酵母菌呼吸方式.实验装置均放在适宜环境中培养8~10h,两组装置中的石灰 2020-05-13 …
酵母菌细胞呼吸方式的两组实验,实验装置均放在30℃的环境中,8~10h后,两组装置中的石灰水都变混 2020-05-13 …
(2010•海淀区二模)根据实验内容回答问题.实验装置图现象及问题实验I是向紫色石蕊溶液中通入CO 2020-06-12 …
“碱石灰”是指CaO和NaOH固体的混合物,它在空气久置会变质.某实验小组为探究一瓶久置的碱石灰样 2020-07-19 …
碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分, 2020-10-31 …
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂,如与空气长时间接触就会放生变质.实验小组 2020-11-05 …
CaO和NaOH固体的混合物俗名“碱石灰”,实验室常用作干燥剂。碱石灰在空气中久置会吸收空气中的水和 2020-11-23 …
CaO和图aOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和 2020-11-23 …
氧化钙和氢氧化钠固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和 2020-11-23 …