早教吧作业答案频道 -->化学-->
N、C、S元素的单质及化合物在工农业生成中有着重要的应用Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:C
题目详情
N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)反应过程中测定的部分数据如下表:
(1)写出光气(COCl2)的电子式___
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=___.该温度下的平衡常数K=___.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是___(填字母序号).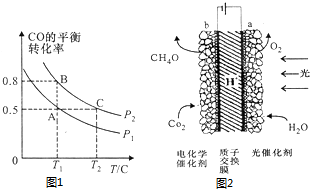
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)___P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为___L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式___.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向___区移动(填“a”或“b”)
②b极上的电极反应式为___.N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)反应过程中测定的部分数据如下表:
(1)写出光气(COCl2)的电子式___
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=___.该温度下的平衡常数K=___.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是___(填字母序号).
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)___P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为___L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式___.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向___区移动(填“a”或“b”)
②b极上的电极反应式为___.
22222
t/min n(CO)/mol n(Cl2)/mol 0 1.20 0.6 1 0.90 2 0.80 4 0.20 t/min n(CO)/mol n(Cl2)/mol t/min n(CO)/mol n(Cl2)/mol 2 0 1.20 0.6 0 1.20 0.6 1 0.90 1 0.90 2 0.80 2 0.80 4 0.20 4 0.20 2
222
2

22
2
2
2
2
322
2223
+
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=___.该温度下的平衡常数K=___.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是___(填字母序号).

A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)___P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为___L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式___.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向___区移动(填“a”或“b”)
②b极上的电极反应式为___.N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=___.该温度下的平衡常数K=___.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是___(填字母序号).

A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)___P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为___L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式___.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向___区移动(填“a”或“b”)
②b极上的电极反应式为___.
22222
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
222
2

22
2
2
2
2
322
2223
+
▼优质解答
答案和解析
I.(1)结构式为: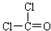 ,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为
,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为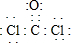 ,故答案为:
,故答案为: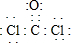 ;
;
(2)2min内参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,生成n(COCl22)=n(CO)(反应)=0.40mol,则v(COCl22)=
=
=0.1mol/(L.min);
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)⇌COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
=0.40mol/L、c(Cl2)=
=0.10mol/L、c(COCl2)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
△t
△n V △n △n △nV V V△t △t △t=
=0.1mol/(L.min);
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)⇌COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
=0.40mol/L、c(Cl2)=
=0.10mol/L、c(COCl2)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
2min
0.40mol 2L 0.40mol 0.40mol 0.40mol2L 2L 2L2min 2min 2min=0.1mol/(L.min);
根据表中数据知,4min时参加反应的n(Cl22)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl22(g)⇌COCl22(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
=0.40mol/L、c(Cl2)=
=0.10mol/L、c(COCl2)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.80mol 2L 0.80mol 0.80mol 0.80mol2L 2L 2L=0.40mol/L、c(Cl22)=
=0.10mol/L、c(COCl2)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.20mol 2L 0.20mol 0.20mol 0.20mol2L 2L 2L=0.10mol/L、c(COCl22)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.40mol 2L 0.40mol 0.40mol 0.40mol2L 2L 2L=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
c(COCl2) c(CO).c(Cl2) c(COCl2) c(COCl2) c(COCl2)2)c(CO).c(Cl2) c(CO).c(Cl2) c(CO).c(Cl2)2)=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.20 0.40×0.10 0.20 0.20 0.200.40×0.10 0.40×0.10 0.40×0.10=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl22的消耗速率等于COCl22的生成速率,不能据此判断平衡状态,故错误;
B.Cl22的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl22的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1122,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl22(g)⇌COCl22(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.25 0.25×0.75 0.25 0.25 0.250.25×0.75 0.25×0.75 0.25×0.75=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
4 3 4 4 43 3 3,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl22(g)⇌COCl22(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
×
8 V 8 8 8V V V
×
×
2 V 2 2 2V V V×
12 V 12 12 12V V V=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
4 3 4 4 43 3 3,V=4
故答案为:4;
II.(1)由CO(g)和CH33OH(l)的燃烧热△H分别为-283.0kJ•mol-1-1和-726.5kJ•mol-1-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
1 2 1 1 12 2 2O22(g)=CO22(g)△H=-283.0kJ•mol-1-1
②CH33OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
3 2 3 3 32 2 2O22(g)=CO22(g)+2 H22O(l)△H=-726.5kJ•mol-1-1
③H22(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
1 2 1 1 12 2 2O22(g)=H22O(l)△H=-286kJ•mol-1-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
2 3 2 2 23 3 3×②得反应CO(g)+2H22(g)=CH33OH(l
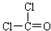 ,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为
,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为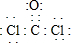 ,故答案为:
,故答案为: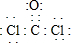 ;
;(2)2min内参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,生成n(COCl22)=n(CO)(反应)=0.40mol,则v(COCl22)=
| ||
| △t |
| ||
| 2min |
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)⇌COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
| 0.80mol |
| 2L |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| ||
| △t |
| △n |
| V |
| △n |
| V |
| △n |
| V |
| △n |
| V |
| ||
| 2min |
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)⇌COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
| 0.80mol |
| 2L |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| ||
| 2min |
| 0.40mol |
| 2L |
| 0.40mol |
| 2L |
| 0.40mol |
| 2L |
| 0.40mol |
| 2L |
根据表中数据知,4min时参加反应的n(Cl22)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl22(g)⇌COCl22(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
| 0.80mol |
| 2L |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.80mol |
| 2L |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl22的消耗速率等于COCl22的生成速率,不能据此判断平衡状态,故错误;
B.Cl22的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl22的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P11
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl22(g)⇌COCl22(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 4 |
| 3 |
则 CO(g)+Cl22(g)⇌COCl22(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| ||||
|
| 8 |
| V |
| 2 |
| V |
| 12 |
| V |
| 8 |
| V |
| 8 |
| V |
| 8 |
| V |
| 2 |
| V |
| 12 |
| V |
| 2 |
| V |
| 12 |
| V |
| 2 |
| V |
| 12 |
| V |
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH33OH(l)的燃烧热△H分别为-283.0kJ•mol-1-1和-726.5kJ•mol-1-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 1 |
| 2 |
②CH33OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 3 |
| 2 |
③H22(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 2 |
| 3 |
看了 N、C、S元素的单质及化合物...的网友还看了以下:
about chinese,help meIn "nǐ zài nǎ lǐ gōng zuò?" 2020-05-14 …
一些电磁学方面的问题1.有效长度是怎么出来的,原理是什么?为什么闭合曲线的有效长度为02.为什么捆 2020-06-03 …
近代化学基础急一1.在用量子数表示核外电子运动状态时,写出下列各组中所缺少的量子数.(1)n=3, 2020-06-04 …
下列各组词语中读音和书写有错误的一项是()A.褴褛(lǚ)生意盎(àng)然B.隽(juàn)永鸢 2020-07-03 …
给出下列关于互不相同的直线m,n,l和平面α,β的四个命题:①m⊂α,l∩α=A,点A∉m,则l与 2020-07-26 …
浓度分别为a%、b%的溶液,质量分别为M、N,交换质量L后浓度都变成c%,则(M-L)/L=L/( 2020-08-03 …
设l,m,n是三条不同的直线,α,β是两个不重合的平面,则下列命题正确的是()A.α∥β,l⊂α,n 2020-11-02 …
根据课文:2.根据拼音写汉字。泛làn()斑lán()怪dàn()门kǎn()lán语()垂xián 2020-11-11 …
张三和李四步行同时由A到B,已知张三每小时比李四快mKM,张三到D时,李四到C,当张三到B时李四到D 2020-11-23 …
原子结构原子中每个电子的运动状态由四个量子数n,l,m,ms确定.假设它的取值规则为:n=1,2,3 2020-12-02 …