用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:(1)烧杯间填满碎泡沫塑料
用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题: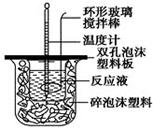
(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),
其原因是_______________________________________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是______________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ _____(填“相等”“不相等”),若实验操作均正确,则所求中和热________________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H 2 O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:__________________________________。
用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),
其原因是_______________________________________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是______________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ _____(填“相等”“不相等”),若实验操作均正确,则所求中和热________________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H 2 O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:__________________________________。
用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是___________________________
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),
其原因是_______________________________________________________。
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是______________________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ _____(填“相等”“不相等”),若实验操作均正确,则所求中和热________________(填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H 2 O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:__________________________________。

2
(1)减少热量损失
(2)不能 ①铁会和盐酸反应 ②铁导热性好,热量损失较大
(3)为了确保盐酸完全被中和 不相等 相等
(4)NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 O(l) △H="-57.3kJ/mol"
解析
分 析:
(1)烧杯间填满碎泡沫塑料的作用是减少热量损失;
(2)环形铁质搅拌棒一是能导热,产生热损失,二是可以与盐酸反应,放热且减少HCl的量,故不能用环形铁质搅拌棒代替环形玻璃搅拌棒;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是为了确保盐酸完全被中和。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,实验反应的物的量增大,所放出的热量最多;但中和热是定值,若实验操作均正确,中和热不会变化。
(4)因为在稀溶液中,强酸和强碱发生中和反应生成1 mol H 2 O时,放出57.3 kJ的热量,所以上述反应的热化学方程式为:NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 O(l) △H=-57.3kJ/mol。
考点:
中和热实验的测定原理及评价。
(1)减少热量损失
(2)不能 ①铁会和盐酸反应 ②铁导热性好,热量损失较大
(3)为了确保盐酸完全被中和 不相等 相等
(4)NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 O(l) △H="-57.3kJ/mol"
(2)不能 ①铁会和盐酸反应 ②铁导热性好,热量损失较大
(3)为了确保盐酸完全被中和 不相等 相等
(4)NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 O(l) △H="-57.3kJ/mol" (1)减少热量损失
(2)不能 ①铁会和盐酸反应 ②铁导热性好,热量损失较大
(3)为了确保盐酸完全被中和 不相等 相等
(4)NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 2 O(l) △H="-57.3kJ/mol"
解析
分 析:
(1)烧杯间填满碎泡沫塑料的作用是减少热量损失;
(2)环形铁质搅拌棒一是能导热,产生热损失,二是可以与盐酸反应,放热且减少HCl的量,故不能用环形铁质搅拌棒代替环形玻璃搅拌棒;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是为了确保盐酸完全被中和。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,实验反应的物的量增大,所放出的热量最多;但中和热是定值,若实验操作均正确,中和热不会变化。
(4)因为在稀溶液中,强酸和强碱发生中和反应生成1 mol H 2 O时,放出57.3 kJ的热量,所以上述反应的热化学方程式为:NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 O(l) △H=-57.3kJ/mol。
考点:
中和热实验的测定原理及评价。
分 析:
(1)烧杯间填满碎泡沫塑料的作用是减少热量损失;
(2)环形铁质搅拌棒一是能导热,产生热损失,二是可以与盐酸反应,放热且减少HCl的量,故不能用环形铁质搅拌棒代替环形玻璃搅拌棒;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是为了确保盐酸完全被中和。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,实验反应的物的量增大,所放出的热量最多;但中和热是定值,若实验操作均正确,中和热不会变化。
(4)因为在稀溶液中,强酸和强碱发生中和反应生成1 mol H 2 O时,放出57.3 kJ的热量,所以上述反应的热化学方程式为:NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 O(l) △H=-57.3kJ/mol。
考点:
中和热实验的测定原理及评价。
分 析:
(1)烧杯间填满碎泡沫塑料的作用是减少热量损失;
(2)环形铁质搅拌棒一是能导热,产生热损失,二是可以与盐酸反应,放热且减少HCl的量,故不能用环形铁质搅拌棒代替环形玻璃搅拌棒;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是为了确保盐酸完全被中和。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,实验反应的物的量增大,所放出的热量最多;但中和热是定值,若实验操作均正确,中和热不会变化。
(4)因为在稀溶液中,强酸和强碱发生中和反应生成1 mol H 2 2 O时,放出57.3 kJ的热量,所以上述反应的热化学方程式为:NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 2 O(l) △H=-57.3kJ/mol。
考点:
中和热实验的测定原理及评价。
3道简单的高二化学题1·在一支25mL酸式滴定管中盛入0.1mol/L的HCl溶液,其液面恰好在5 2020-05-17 …
化学题!亲们进来帮忙啊~在250ml某混合溶液中,HNO3和H2SO4物质的量浓度分别为0.2mo 2020-06-06 …
在无土栽培中需用浓度为0.5 mol·L-1 NH4Cl、0.16 mol·L-1 KCl、0.2 2020-06-27 …
.今欲配制一pH=7.20的缓冲溶液,所用0.10 mol/L H3PO4和0.10 mol/L 2020-06-27 …
下列各对溶液用半透膜隔开水分子的渗透方向0.2mol•L-1KCl和0.2mol·L-1蔗糖溶液0 2020-07-08 …
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ 2020-07-19 …
某实验小组的同学用0.5mol/L的NaOH溶液与0.5mol/L的H2SO4溶液进行中和热的测定 2020-07-19 …
1.将100mL0.20mol·L-1HAc和50mL0.20mol·L-1NaOH溶液混合,求混合 2020-11-01 …
0.1mol/LMV采用改进后的格里斯试剂染色法进行测定,测定酶活反应体系共250μL:0.1mol 2020-12-25 …
常温下,有下列水溶液:①pH=0的盐酸②0.5mol•L-1的盐酸③0.1mol•L-1的NH4Cl 2021-02-01 …