早教吧作业答案频道 -->化学-->
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1NaOH溶液若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体gⅡ.测定稀硫酸和稀氢氧化钠
题目详情
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体___g
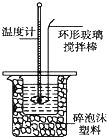
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①表中的温度差平均值为___℃
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=“4.18“J•(g•℃)-1.则该反应的热化学方程式为___(计算取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)___.
a.实验装置保温、隔热效果差
b.所用硫酸为浓硫酸
c.环形玻璃搅拌棒改为铜质搅拌棒
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液.
Ⅰ.配制0.50mol•L-1 NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体___g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=“4.18“J•(g•℃)-1.则该反应的热化学方程式为___(计算取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)___.
a.实验装置保温、隔热效果差
b.所用硫酸为浓硫酸
c.环形玻璃搅拌棒改为铜质搅拌棒
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液.

▼优质解答
答案和解析
Ⅰ.(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,故答案为:5.0;
Ⅱ.(1)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2数据舍去,其他三次温度差平均值=
=4.0℃,
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-
=-53.5 kJ/mol,即稀强酸、稀强碱反应生成1mol液态水时放出53.5kJ热量,稀硫酸和氢氧化钠稀溶液反应的热化学方程式为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol,
故答案为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热数值偏小,故a正确;
b.所用硫酸为浓硫酸,浓硫酸稀释放热,测得的热量偏大,中和热数值偏大,故b错误;
c.铜质搅拌棒导热,热量散失,测得的热量偏小,中和热数值偏小,故c正确;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小,中和热数值偏小,故d正确.
故答案为:acd.
Ⅱ.(1)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2数据舍去,其他三次温度差平均值=
| 4.0℃+3.9℃+4.1℃ |
| 3 |
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-
| 1.3376KJ |
| 0.025mol |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
③a.装置保温、隔热效果差,测得的热量偏小,中和热数值偏小,故a正确;
b.所用硫酸为浓硫酸,浓硫酸稀释放热,测得的热量偏大,中和热数值偏大,故b错误;
c.铜质搅拌棒导热,热量散失,测得的热量偏小,中和热数值偏小,故c正确;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小,中和热数值偏小,故d正确.
故答案为:acd.
看了 某实验小组用0.50mol•...的网友还看了以下:
若要用NaCl配制0.5mol/L的NaCl溶液,5%的NaCl溶液,在实验操作步骤上有哪些不同若 2020-05-16 …
在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,出现的现象1.有蓝色晶体析出 2.饱和溶液的溶质减少 2020-05-16 …
实验室现有两瓶失去标签的的无色溶液,只知道它们是10%的NaOH溶液和5%的NaOH溶液.现只提供 2020-06-02 …
是非:1.正常人,血液的pH值总是维持在7.35~7.45范围内2.把pH=3与pH=5的酸溶液等 2020-06-04 …
请教老师如何使用柠檬酸配制PH2.5的100ml水溶液?溶剂:水溶质:分析纯柠檬酸目标:PH2.5 2020-07-02 …
对某无色溶液进行下列实验,根据实验现象的出的结论中,错误的是1.滴入紫色石蕊溶液颜色变红,则该溶液 2020-07-20 …
某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、I-等阴离子.某同学取5份 2020-11-02 …
1配制0.1的h2so4溶液98kg许0.98的浓溶液多少kg需加水多少kg220度是kno3的溶解 2020-11-05 …
同学们在实验室用5%的H2O2溶液制取氧气并进行氧气性质实验.溶液配制:(1)用50ml30%的H2 2020-11-28 …
下列四种溶液中,水的电离程度最大的是()A.pH=5的NH4Cl溶液B.pH=5的NaHSO4溶液C 2021-02-01 …