早教吧作业答案频道 -->化学-->
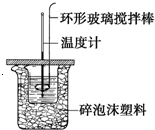
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol•L-1NaOH溶液,并用同一温度计测出其温度;③将Na
题目详情
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)倒入NaOH溶液的正确操作是___ (填序号).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是___ (填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol•L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为___.
(4)假设稀盐酸和稀氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后所得溶液的比热容c=4.18J•g-1℃-1.为了计算中和热,某学生实验数据记录如下:
依据该学生的实验数据计算,该实验测得的中和热△H=___(结果保留一位小数).
-1-1

-1123123
-3-1-1
实验序号 起始温度t1/℃ 终止温度t1/℃ 盐酸 氢氧化钠溶液 混合溶液 1 20.0 20.1 23.2 2 20.2 20.4 23.4 3 20.5 20.6 23.6 实验序号 起始温度t1/℃ 终止温度t1/℃ 实验序号 起始温度t1/℃ 1终止温度t1/℃ 1 盐酸 氢氧化钠溶液 混合溶液 盐酸 氢氧化钠溶液 混合溶液 1 20.0 20.1 23.2 1 20.0 20.1 23.2 2 20.2 20.4 23.4 2 20.2 20.4 23.4 3 20.5 20.6 23.6 3 20.5 20.6 23.6
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:

(1)倒入NaOH溶液的正确操作是___ (填序号).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是___ (填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol•L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为___.
(4)假设稀盐酸和稀氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后所得溶液的比热容c=4.18J•g-1℃-1.为了计算中和热,某学生实验数据记录如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t1/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
-1-1

-1123123
-3-1-1
| 实验序号 | 起始温度t1/℃ | 终止温度t1/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
▼优质解答
答案和解析
(1)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故选C;
(2)使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失,
故选D;
(3)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1mol•L-1-1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1mol•L-1-1的稀盐酸恰好完全反应放热小于57.3kJ,反应焓变是负值,所以△H11=△H22<△H33;
故答案为:△H11=△H22<△H33;
(4)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为:23.6℃,反应前后温度差为:3.05℃;
50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm33=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×
=1.296kJ,即生成0.025mol的水放出热量为:1.3kJ,所以生成1mol的水放出热量为1.296kJ×
=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,
故答案为:-51.8kJ/mol.
3.15℃+3.1℃+3.05℃ 3 3.15℃+3.1℃+3.05℃ 3.15℃+3.1℃+3.05℃ 3.15℃+3.1℃+3.05℃3 3 3=1.296kJ,即生成0.025mol的水放出热量为:1.3kJ,所以生成1mol的水放出热量为1.296kJ×
=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,
故答案为:-51.8kJ/mol.
1mol 0.025mol 1mol 1mol 1mol0.025mol 0.025mol 0.025mol=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,
故答案为:-51.8kJ/mol.
故选C;
(2)使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失,
故选D;
(3)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1mol•L-1-1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1mol•L-1-1的稀盐酸恰好完全反应放热小于57.3kJ,反应焓变是负值,所以△H11=△H22<△H33;
故答案为:△H11=△H22<△H33;
(4)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为:23.6℃,反应前后温度差为:3.05℃;
50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm33=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×
| 3.15℃+3.1℃+3.05℃ |
| 3 |
| 1mol |
| 0.025mol |
故答案为:-51.8kJ/mol.
| 3.15℃+3.1℃+3.05℃ |
| 3 |
| 1mol |
| 0.025mol |
故答案为:-51.8kJ/mol.
| 1mol |
| 0.025mol |
故答案为:-51.8kJ/mol.
看了 利用如图所示装置测定中和热的...的网友还看了以下:
圆0和o'都经过点A,B.点P在BA延长线上,过P作圆O的割线PCD交圆0于CD两点作圆o'的切线P 2020-03-31 …
喜树的化学式、、喜树中含有一种被称为喜树碱,这种碱的式量在300-400之间,实验分析得知其元素组 2020-04-11 …
喜树中含有一种被称为喜树碱的生物碱,这种碱的相对分子质量在300~400之间,实验分析得知其元素组 2020-04-25 …
喜树中含有一种被称为喜树碱的生物碱,这种碱的相对分子质量在300~400之间,实验分析得知其元素组 2020-04-25 …
喜树中含有一种被称为喜树碱的生物碱,这种碱的相对分子质量在300~400之间,实验分析得知其元素组 2020-05-13 …
喜树中含有一种被称为喜树碱的生物碱,这种碱的相对分子质量在300~400之间,实验分析得知其元素组 2020-05-20 …
(2010•内江)用“伏安法”测量阻值约为7Ω的电阻的阻值,现备有的实验器材有:A.待测电阻Rx; 2020-06-30 …
分子中原子个数问题喜树中含有一种被称为喜树碱的生物碱,这种碱的相对分子质量在300-400之间,实 2020-07-01 …
(o)0.o25×0.d2×5=(2)o.25×0.25÷oo6=(d)0.25×o.25÷o6如 2020-07-09 …
已知xyz三维坐标系上点A(0,0,1),B(1,1,0),C(0,1,0),O(0,0,0),已 2020-07-30 …