早教吧作业答案频道 -->化学-->
50mL0.5mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少一种玻璃
题目详情
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
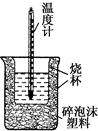
(1)从实验装置上看,图中尚缺少一种玻璃仪器是___.
(2)大烧杯上如不盖硬纸板,测得的中和热___(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“偏大”或“相等”或“偏小”),所求中和热___(填“相等”或“不相等”),简述理由:___.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会___.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
则中和热△H=___(取小数点后一位).
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃)) 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少一种玻璃仪器是___.
(2)大烧杯上如不盖硬纸板,测得的中和热___(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“偏大”或“相等”或“偏小”),所求中和热___(填“相等”或“不相等”),简述理由:___.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会___.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
则中和热△H=___(取小数点后一位).
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))-1-1

-1-1
-1-1
温度
实验次数
起始温度T1/℃ 终止温度T2/℃
温度差平均值(T2-T1)/℃
H2SO4 NaOH 平均值 1 26.2 26.0 30.1 2 27.0 27.4 33.3 3 25.9 25.9 29.8 4 26.4 26.2 30.4 温度
实验次数
起始温度T1/℃ 终止温度T2/℃
温度差平均值(T2-T1)/℃
温度
实验次数
起始温度T1/℃ 1终止温度T2/℃
温度差平均值(T2-T1)/℃
21
H2SO4 NaOH 平均值 H2SO4 24NaOH 平均值 1 26.2 26.0 30.1 1 26.2 26.0 30.1 2 27.0 27.4 33.3 2 27.0 27.4 33.3 3 25.9 25.9 29.8 3 25.9 25.9 29.8 4 26.4 26.2 30.4 4 26.4 26.2 30.4

(1)从实验装置上看,图中尚缺少一种玻璃仪器是___.
(2)大烧杯上如不盖硬纸板,测得的中和热___(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“偏大”或“相等”或“偏小”),所求中和热___(填“相等”或“不相等”),简述理由:___.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会___.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃)) 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少一种玻璃仪器是___.
(2)大烧杯上如不盖硬纸板,测得的中和热___(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“偏大”或“相等”或“偏小”),所求中和热___(填“相等”或“不相等”),简述理由:___.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会___.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))-1-1

-1-1
-1-1
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
实验次数
实验次数
实验次数
▼优质解答
答案和解析
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,但中和热为负值,所以测得的中和热偏大;
故答案为:偏大;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.50mol•L-1-1盐酸跟50mL 0.50mol•L-1-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol•L-1-1盐酸跟50mL 0.50mol•L-1-1 NaOH溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1molH22O放出的热量,与酸碱的用量无关;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,中和热数值会偏小;中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用50mL 0.5mol•L-1-1盐酸与50mL 0.50mol•L-1-1 NaOH溶液进行上述实验,测得的中和热的数值无影响;
故答案为:偏小;无影响;
(5)第1次实验盐酸和NaOH溶液起始平均温度为26.1℃,反应后温度为30.1℃,反应前后温度差为4.0℃;
第2次实验盐酸和NaOH溶液起始平均温度为27.2℃,反应后温度为33.3℃,反应前后温度差为:6.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为25.9℃,反应后温度为29.8℃,反应前后温度差为:3.9℃;
第4次实验盐酸和NaOH溶液起始平均温度为26.3℃,反应后温度为30.4℃,反应前后温度差为:4.1℃;
第2组数据相差较大,舍去,三次试验的平均值为4.0℃;
取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80mL×1g/cm33=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.2J/(g•℃)×4.0℃=1344J,即1.344KJ,所以实验测得的中和热△H=-
=-53.8kJ/mol;
故答案为:-53.8kJ/mol.
1.344KJ 0.025mol 1.344KJ 1.344KJ 1.344KJ0.025mol 0.025mol 0.025mol=-53.8kJ/mol;
故答案为:-53.8kJ/mol.
故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,但中和热为负值,所以测得的中和热偏大;
故答案为:偏大;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.50mol•L-1-1盐酸跟50mL 0.50mol•L-1-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol•L-1-1盐酸跟50mL 0.50mol•L-1-1 NaOH溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1molH22O放出的热量,与酸碱的用量无关;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,中和热数值会偏小;中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用50mL 0.5mol•L-1-1盐酸与50mL 0.50mol•L-1-1 NaOH溶液进行上述实验,测得的中和热的数值无影响;
故答案为:偏小;无影响;
(5)第1次实验盐酸和NaOH溶液起始平均温度为26.1℃,反应后温度为30.1℃,反应前后温度差为4.0℃;
第2次实验盐酸和NaOH溶液起始平均温度为27.2℃,反应后温度为33.3℃,反应前后温度差为:6.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为25.9℃,反应后温度为29.8℃,反应前后温度差为:3.9℃;
第4次实验盐酸和NaOH溶液起始平均温度为26.3℃,反应后温度为30.4℃,反应前后温度差为:4.1℃;
第2组数据相差较大,舍去,三次试验的平均值为4.0℃;
取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80mL×1g/cm33=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.2J/(g•℃)×4.0℃=1344J,即1.344KJ,所以实验测得的中和热△H=-
| 1.344KJ |
| 0.025mol |
故答案为:-53.8kJ/mol.
| 1.344KJ |
| 0.025mol |
故答案为:-53.8kJ/mol.
看了 50mL0.5mol•L-1...的网友还看了以下:
关于货币流通规律的解释货币流通规律:在一定时期内,流通中所需要的货币量筒商品价格总额成正比,同货币 2020-05-17 …
①为什么流通中需要的货币数量与货币流通速度成反比?②(未完待续)问两个问题:①为什么流通中需要的货 2020-07-14 …
某国去年的商品价格总额为20万亿元,流通中所需要的货币量为4万亿元。回答题。7.假如货币流通速度不 2020-07-20 …
所谓“通货”,就是流通中的货币。通货膨胀是流通中的纸币大大超过了流通中所需要的数量,纸币太多了。通货 2020-11-23 …
关于流通中所需货币量货币流通速度,也就是同一货币在一定时期内转手的次数.流通中所需要的货币量与货币的 2020-12-05 …
流通中的货币既不是越多越好,也不是越少越好。下列关于流通中货币量的认识正确的是①流通中所需要的货币量 2020-12-05 …
流通中的货币既不是越多越好,也不是越少越好。下列关于流通中货币量的认识正确的是①流通中所需要的货币量 2020-12-05 …
请解释高一必修一政治书上的一个规律.第一课神奇的货币中,第七页,书上说商品流通过程中实际所需要的货币 2020-12-05 …
1.一定时期内商品流通中所需的货币量,取决于()A.货币流通速度B.商品价格水平C.市场竞争机制D. 2020-12-05 …
流通中的货币既不是越多越好,也不是越少越好。下列关于流通中货币量的认识正确的是()①流通中所需要的货 2020-12-16 …