早教吧作业答案频道 -->化学-->
通过对化学的学习,你已经掌握了实验室制取气体的有关规律,请结合如图1回答问题:(1)用装置A制氧气.①用装置A制氧气的化学方程式为.②冬冬用AD相连制取和收集的氧气,来做铁
题目详情
通过对化学的学习,你已经掌握了实验室制取气体的有关规律,请结合如图1回答问题:
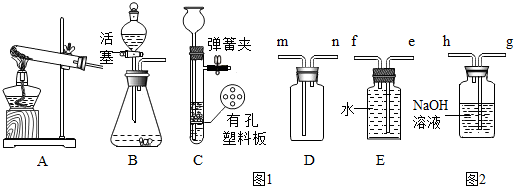
(1)用装置A制氧气.
①用装置A制氧气的化学方程式为___.
②冬冬用AD相连制取和收集的氧气,来做铁丝在氧气中燃烧的实验,结果没有观察到剧烈燃烧,火星四射的现象.你认为下列不属于该实验失败的主要原因是___.
A.氧气不纯 B.集气瓶没预先装少量水
C.铁丝太粗 D.系在铁丝上的木柴燃烧尽了,才将铁丝伸入集气瓶
(2)同学们用二氧化锰催化过氧化氢溶液的方法制氧气时,探究了影响化学反应速率的部分因素,实验数据如下表:
①二氧化锰催化过氧化氢溶液的方法制氧气的化学方程式为___.
②通过实验Ⅰ和Ⅱ对比可知,化学反应速率与___有关;从实验Ⅲ和Ⅳ对比可知,化学反应速率与温度的关系是___.
③化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是___.
④用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量是减小、不变还是增大呢?___.
⑤学习了双氧水制氧气的实验后,王林同学想起自己家里有一瓶消毒用的双氧水,经查看发现已过期,他用实验证明了这瓶双氧水已经完全变质.请你猜想王林同学的实验步骤是:___,对应的实验现象是___.
(3)实验室常用硫化亚铁的块状固体与稀盐酸(液体)在常温下反应制硫化氢气体.硫化氢气体是无色有刺激性气味的有毒气体,它的密度比空气大,易溶于水.
①制取硫化氢时选用的发生装置___或___.
②硫化氢气体排放到空气中会污染空气.硫化氢气体可被水吸收,用碱液(如NaOH溶液)吸收效果最好.收集硫化氢气体时,应将___端(选填m、n、e、f)与图2的___端(填g、h)相连.

实验
序号 过氧化氢溶液浓度∕% 过氧化氢溶液体积∕m L 温度∕℃ 二氧化锰的用量∕g 收集氧气的体积∕m L 反应所需的时间∕s Ⅰ 5 1 20 0.1 4 16.75 Ⅱ 15 1 20 0.1 4 6.04 Ⅲ 30 5 35 2 49.21 Ⅳ 30 5 55 2 10.76 实验
序号 过氧化氢溶液浓度∕% 过氧化氢溶液体积∕m L 温度∕℃ 二氧化锰的用量∕g 收集氧气的体积∕m L 反应所需的时间∕s 实验
序号
过氧化氢溶液浓度∕% 过氧化氢溶液体积∕m L 温度∕℃ 二氧化锰的用量∕g 收集氧气的体积∕m L 反应所需的时间∕s Ⅰ 5 1 20 0.1 4 16.75 Ⅰ 5 1 20 0.1 4 16.75 Ⅱ 15 1 20 0.1 4 6.04 Ⅱ 15 1 20 0.1 4 6.04 Ⅲ 30 5 35 2 49.21 Ⅲ 30 5 35 2 49.21 Ⅳ 30 5 55 2 10.76 Ⅳ 30 5 55 2 10.76

(1)用装置A制氧气.
①用装置A制氧气的化学方程式为___.
②冬冬用AD相连制取和收集的氧气,来做铁丝在氧气中燃烧的实验,结果没有观察到剧烈燃烧,火星四射的现象.你认为下列不属于该实验失败的主要原因是___.
A.氧气不纯 B.集气瓶没预先装少量水
C.铁丝太粗 D.系在铁丝上的木柴燃烧尽了,才将铁丝伸入集气瓶
(2)同学们用二氧化锰催化过氧化氢溶液的方法制氧气时,探究了影响化学反应速率的部分因素,实验数据如下表:
| 实验 序号 | 过氧化氢溶液浓度∕% | 过氧化氢溶液体积∕m L | 温度∕℃ | 二氧化锰的用量∕g | 收集氧气的体积∕m L | 反应所需的时间∕s |
| Ⅰ | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| Ⅱ | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| Ⅲ | 30 | 5 | 35 | 2 | 49.21 | |
| Ⅳ | 30 | 5 | 55 | 2 | 10.76 |
②通过实验Ⅰ和Ⅱ对比可知,化学反应速率与___有关;从实验Ⅲ和Ⅳ对比可知,化学反应速率与温度的关系是___.
③化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是___.
④用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量是减小、不变还是增大呢?___.
⑤学习了双氧水制氧气的实验后,王林同学想起自己家里有一瓶消毒用的双氧水,经查看发现已过期,他用实验证明了这瓶双氧水已经完全变质.请你猜想王林同学的实验步骤是:___,对应的实验现象是___.
(3)实验室常用硫化亚铁的块状固体与稀盐酸(液体)在常温下反应制硫化氢气体.硫化氢气体是无色有刺激性气味的有毒气体,它的密度比空气大,易溶于水.
①制取硫化氢时选用的发生装置___或___.
②硫化氢气体排放到空气中会污染空气.硫化氢气体可被水吸收,用碱液(如NaOH溶液)吸收效果最好.收集硫化氢气体时,应将___端(选填m、n、e、f)与图2的___端(填g、h)相连.

| 实验 序号 | 过氧化氢溶液浓度∕% | 过氧化氢溶液体积∕m L | 温度∕℃ | 二氧化锰的用量∕g | 收集氧气的体积∕m L | 反应所需的时间∕s |
| Ⅰ | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| Ⅱ | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| Ⅲ | 30 | 5 | 35 | 2 | 49.21 | |
| Ⅳ | 30 | 5 | 55 | 2 | 10.76 |
序号
序号
序号
▼优质解答
答案和解析
(1)①该装置适用于固体加热制取氧气,试管口没有没有棉花团,所以是加热氯酸钾与二氧化锰的混合物来制取氧气;故填:2KClO33
2KCl+3O2↑;
②没有观察到火星四射,说明没有燃烧现象,也是就没有发生铁丝的燃烧,故所有分析可围绕燃烧来进行,更确切地说是铁丝的燃烧条件来进行.燃烧需要可燃物与氧气有一定的接触,且接触越充分越容易燃烧,氧气的浓度越大越易燃烧,温度越高燃烧也易发生;
A、收集到的氧气纯度太低时,铁丝可能不燃烧,故不符合题意;
B、集气瓶底部预先放入水的目的是为了防止生成物溅落炸裂集气瓶的,与铁丝是否能够燃烧无关,符合题意;
C、铁丝太粗,与氧气接触不充分,铁丝可能不燃烧,故不符合题意;
D、待铁丝上的火柴燃烧尽了,才将铁丝伸入集气瓶,铁丝的温度未达到着火点,铁丝不燃烧,故不符合题意;
故选B;
(2)①过氧化氢分解产生了氧气和水,所以可以写出该反应的化学方程式:2H2O2
2H2O+O2↑;故填:2H2O2
2H2O+O2↑;
②从表中分析可知:ⅠⅡ中除了过氧化氢浓度不同之外,其他的各种量均相同,所以可以判断出是反应物的浓度影响了反应速率,并且是浓度越大,反应速率越快;ⅢⅣ则是温度不同其他条件相同,温度高的反应速率快;故填:反应物浓度;温度越高,化学反应速率越快;
③物质在反应时接触面积越大,反应速率越快,而反应物的浓度越大,在溶液中粒子间接触的机会更多,即粒子间碰撞的概率越大,所以反应速率也就越快;故填:粒子间碰撞的概率越大,化学反应速率越快;
④根据质量守恒定律可以知道,生成物的质量只与反应物的质量多少有关,而与反应物的浓度无关,所以本题中是向过氧化氢溶液中加入了水,而没有改变过氧化氢溶液中溶质的质量,所以产生氧气的质量不会改变;故填:不变;
⑤根据过氧化氢溶液中加入二氧化锰可以产生氧气的性质,取这瓶双氧水放入试管中,加入适量二氧化锰,如有气泡产生,说明没变质,否则就已变质.故填:取这瓶双氧水放入试管中,加入适量二氧化锰;没有气泡产生;
(3)①实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)在常温下通过发生反应制得硫化氢气体,属于固液常温型,因此应该选取装置BC来制取硫化氢气体;
②因为硫化氢气体的密度比空气大,因此氯化氢气体应从m端进入,空气从n排出;用于洗气时长进,故n端连接g;
故答案为:①B;C;②n;g.
△
MnO2 MnO2 MnO2 MnO2 2 △ △ △2KCl+3O22↑;
②没有观察到火星四射,说明没有燃烧现象,也是就没有发生铁丝的燃烧,故所有分析可围绕燃烧来进行,更确切地说是铁丝的燃烧条件来进行.燃烧需要可燃物与氧气有一定的接触,且接触越充分越容易燃烧,氧气的浓度越大越易燃烧,温度越高燃烧也易发生;
A、收集到的氧气纯度太低时,铁丝可能不燃烧,故不符合题意;
B、集气瓶底部预先放入水的目的是为了防止生成物溅落炸裂集气瓶的,与铁丝是否能够燃烧无关,符合题意;
C、铁丝太粗,与氧气接触不充分,铁丝可能不燃烧,故不符合题意;
D、待铁丝上的火柴燃烧尽了,才将铁丝伸入集气瓶,铁丝的温度未达到着火点,铁丝不燃烧,故不符合题意;
故选B;
(2)①过氧化氢分解产生了氧气和水,所以可以写出该反应的化学方程式:2H22O22
2H2O+O2↑;故填:2H2O2
2H2O+O2↑;
②从表中分析可知:ⅠⅡ中除了过氧化氢浓度不同之外,其他的各种量均相同,所以可以判断出是反应物的浓度影响了反应速率,并且是浓度越大,反应速率越快;ⅢⅣ则是温度不同其他条件相同,温度高的反应速率快;故填:反应物浓度;温度越高,化学反应速率越快;
③物质在反应时接触面积越大,反应速率越快,而反应物的浓度越大,在溶液中粒子间接触的机会更多,即粒子间碰撞的概率越大,所以反应速率也就越快;故填:粒子间碰撞的概率越大,化学反应速率越快;
④根据质量守恒定律可以知道,生成物的质量只与反应物的质量多少有关,而与反应物的浓度无关,所以本题中是向过氧化氢溶液中加入了水,而没有改变过氧化氢溶液中溶质的质量,所以产生氧气的质量不会改变;故填:不变;
⑤根据过氧化氢溶液中加入二氧化锰可以产生氧气的性质,取这瓶双氧水放入试管中,加入适量二氧化锰,如有气泡产生,说明没变质,否则就已变质.故填:取这瓶双氧水放入试管中,加入适量二氧化锰;没有气泡产生;
(3)①实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)在常温下通过发生反应制得硫化氢气体,属于固液常温型,因此应该选取装置BC来制取硫化氢气体;
②因为硫化氢气体的密度比空气大,因此氯化氢气体应从m端进入,空气从n排出;用于洗气时长进,故n端连接g;
故答案为:①B;C;②n;g.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑;故填:2H22O22
2H2O+O2↑;
②从表中分析可知:ⅠⅡ中除了过氧化氢浓度不同之外,其他的各种量均相同,所以可以判断出是反应物的浓度影响了反应速率,并且是浓度越大,反应速率越快;ⅢⅣ则是温度不同其他条件相同,温度高的反应速率快;故填:反应物浓度;温度越高,化学反应速率越快;
③物质在反应时接触面积越大,反应速率越快,而反应物的浓度越大,在溶液中粒子间接触的机会更多,即粒子间碰撞的概率越大,所以反应速率也就越快;故填:粒子间碰撞的概率越大,化学反应速率越快;
④根据质量守恒定律可以知道,生成物的质量只与反应物的质量多少有关,而与反应物的浓度无关,所以本题中是向过氧化氢溶液中加入了水,而没有改变过氧化氢溶液中溶质的质量,所以产生氧气的质量不会改变;故填:不变;
⑤根据过氧化氢溶液中加入二氧化锰可以产生氧气的性质,取这瓶双氧水放入试管中,加入适量二氧化锰,如有气泡产生,说明没变质,否则就已变质.故填:取这瓶双氧水放入试管中,加入适量二氧化锰;没有气泡产生;
(3)①实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)在常温下通过发生反应制得硫化氢气体,属于固液常温型,因此应该选取装置BC来制取硫化氢气体;
②因为硫化氢气体的密度比空气大,因此氯化氢气体应从m端进入,空气从n排出;用于洗气时长进,故n端连接g;
故答案为:①B;C;②n;g.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑;
②从表中分析可知:ⅠⅡ中除了过氧化氢浓度不同之外,其他的各种量均相同,所以可以判断出是反应物的浓度影响了反应速率,并且是浓度越大,反应速率越快;ⅢⅣ则是温度不同其他条件相同,温度高的反应速率快;故填:反应物浓度;温度越高,化学反应速率越快;
③物质在反应时接触面积越大,反应速率越快,而反应物的浓度越大,在溶液中粒子间接触的机会更多,即粒子间碰撞的概率越大,所以反应速率也就越快;故填:粒子间碰撞的概率越大,化学反应速率越快;
④根据质量守恒定律可以知道,生成物的质量只与反应物的质量多少有关,而与反应物的浓度无关,所以本题中是向过氧化氢溶液中加入了水,而没有改变过氧化氢溶液中溶质的质量,所以产生氧气的质量不会改变;故填:不变;
⑤根据过氧化氢溶液中加入二氧化锰可以产生氧气的性质,取这瓶双氧水放入试管中,加入适量二氧化锰,如有气泡产生,说明没变质,否则就已变质.故填:取这瓶双氧水放入试管中,加入适量二氧化锰;没有气泡产生;
(3)①实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H22SO44)在常温下通过发生反应制得硫化氢气体,属于固液常温型,因此应该选取装置BC来制取硫化氢气体;
②因为硫化氢气体的密度比空气大,因此氯化氢气体应从m端进入,空气从n排出;用于洗气时长进,故n端连接g;
故答案为:①B;C;②n;g.
| ||
| △ |
②没有观察到火星四射,说明没有燃烧现象,也是就没有发生铁丝的燃烧,故所有分析可围绕燃烧来进行,更确切地说是铁丝的燃烧条件来进行.燃烧需要可燃物与氧气有一定的接触,且接触越充分越容易燃烧,氧气的浓度越大越易燃烧,温度越高燃烧也易发生;
A、收集到的氧气纯度太低时,铁丝可能不燃烧,故不符合题意;
B、集气瓶底部预先放入水的目的是为了防止生成物溅落炸裂集气瓶的,与铁丝是否能够燃烧无关,符合题意;
C、铁丝太粗,与氧气接触不充分,铁丝可能不燃烧,故不符合题意;
D、待铁丝上的火柴燃烧尽了,才将铁丝伸入集气瓶,铁丝的温度未达到着火点,铁丝不燃烧,故不符合题意;
故选B;
(2)①过氧化氢分解产生了氧气和水,所以可以写出该反应的化学方程式:2H2O2
| ||
| ||
②从表中分析可知:ⅠⅡ中除了过氧化氢浓度不同之外,其他的各种量均相同,所以可以判断出是反应物的浓度影响了反应速率,并且是浓度越大,反应速率越快;ⅢⅣ则是温度不同其他条件相同,温度高的反应速率快;故填:反应物浓度;温度越高,化学反应速率越快;
③物质在反应时接触面积越大,反应速率越快,而反应物的浓度越大,在溶液中粒子间接触的机会更多,即粒子间碰撞的概率越大,所以反应速率也就越快;故填:粒子间碰撞的概率越大,化学反应速率越快;
④根据质量守恒定律可以知道,生成物的质量只与反应物的质量多少有关,而与反应物的浓度无关,所以本题中是向过氧化氢溶液中加入了水,而没有改变过氧化氢溶液中溶质的质量,所以产生氧气的质量不会改变;故填:不变;
⑤根据过氧化氢溶液中加入二氧化锰可以产生氧气的性质,取这瓶双氧水放入试管中,加入适量二氧化锰,如有气泡产生,说明没变质,否则就已变质.故填:取这瓶双氧水放入试管中,加入适量二氧化锰;没有气泡产生;
(3)①实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)在常温下通过发生反应制得硫化氢气体,属于固液常温型,因此应该选取装置BC来制取硫化氢气体;
②因为硫化氢气体的密度比空气大,因此氯化氢气体应从m端进入,空气从n排出;用于洗气时长进,故n端连接g;
故答案为:①B;C;②n;g.
| ||
| △ |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.②没有观察到火星四射,说明没有燃烧现象,也是就没有发生铁丝的燃烧,故所有分析可围绕燃烧来进行,更确切地说是铁丝的燃烧条件来进行.燃烧需要可燃物与氧气有一定的接触,且接触越充分越容易燃烧,氧气的浓度越大越易燃烧,温度越高燃烧也易发生;
A、收集到的氧气纯度太低时,铁丝可能不燃烧,故不符合题意;
B、集气瓶底部预先放入水的目的是为了防止生成物溅落炸裂集气瓶的,与铁丝是否能够燃烧无关,符合题意;
C、铁丝太粗,与氧气接触不充分,铁丝可能不燃烧,故不符合题意;
D、待铁丝上的火柴燃烧尽了,才将铁丝伸入集气瓶,铁丝的温度未达到着火点,铁丝不燃烧,故不符合题意;
故选B;
(2)①过氧化氢分解产生了氧气和水,所以可以写出该反应的化学方程式:2H22O22
| ||
| ||
②从表中分析可知:ⅠⅡ中除了过氧化氢浓度不同之外,其他的各种量均相同,所以可以判断出是反应物的浓度影响了反应速率,并且是浓度越大,反应速率越快;ⅢⅣ则是温度不同其他条件相同,温度高的反应速率快;故填:反应物浓度;温度越高,化学反应速率越快;
③物质在反应时接触面积越大,反应速率越快,而反应物的浓度越大,在溶液中粒子间接触的机会更多,即粒子间碰撞的概率越大,所以反应速率也就越快;故填:粒子间碰撞的概率越大,化学反应速率越快;
④根据质量守恒定律可以知道,生成物的质量只与反应物的质量多少有关,而与反应物的浓度无关,所以本题中是向过氧化氢溶液中加入了水,而没有改变过氧化氢溶液中溶质的质量,所以产生氧气的质量不会改变;故填:不变;
⑤根据过氧化氢溶液中加入二氧化锰可以产生氧气的性质,取这瓶双氧水放入试管中,加入适量二氧化锰,如有气泡产生,说明没变质,否则就已变质.故填:取这瓶双氧水放入试管中,加入适量二氧化锰;没有气泡产生;
(3)①实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)在常温下通过发生反应制得硫化氢气体,属于固液常温型,因此应该选取装置BC来制取硫化氢气体;
②因为硫化氢气体的密度比空气大,因此氯化氢气体应从m端进入,空气从n排出;用于洗气时长进,故n端连接g;
故答案为:①B;C;②n;g.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.
| ||
②从表中分析可知:ⅠⅡ中除了过氧化氢浓度不同之外,其他的各种量均相同,所以可以判断出是反应物的浓度影响了反应速率,并且是浓度越大,反应速率越快;ⅢⅣ则是温度不同其他条件相同,温度高的反应速率快;故填:反应物浓度;温度越高,化学反应速率越快;
③物质在反应时接触面积越大,反应速率越快,而反应物的浓度越大,在溶液中粒子间接触的机会更多,即粒子间碰撞的概率越大,所以反应速率也就越快;故填:粒子间碰撞的概率越大,化学反应速率越快;
④根据质量守恒定律可以知道,生成物的质量只与反应物的质量多少有关,而与反应物的浓度无关,所以本题中是向过氧化氢溶液中加入了水,而没有改变过氧化氢溶液中溶质的质量,所以产生氧气的质量不会改变;故填:不变;
⑤根据过氧化氢溶液中加入二氧化锰可以产生氧气的性质,取这瓶双氧水放入试管中,加入适量二氧化锰,如有气泡产生,说明没变质,否则就已变质.故填:取这瓶双氧水放入试管中,加入适量二氧化锰;没有气泡产生;
(3)①实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)在常温下通过发生反应制得硫化氢气体,属于固液常温型,因此应该选取装置BC来制取硫化氢气体;
②因为硫化氢气体的密度比空气大,因此氯化氢气体应从m端进入,空气从n排出;用于洗气时长进,故n端连接g;
故答案为:①B;C;②n;g.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.②从表中分析可知:ⅠⅡ中除了过氧化氢浓度不同之外,其他的各种量均相同,所以可以判断出是反应物的浓度影响了反应速率,并且是浓度越大,反应速率越快;ⅢⅣ则是温度不同其他条件相同,温度高的反应速率快;故填:反应物浓度;温度越高,化学反应速率越快;
③物质在反应时接触面积越大,反应速率越快,而反应物的浓度越大,在溶液中粒子间接触的机会更多,即粒子间碰撞的概率越大,所以反应速率也就越快;故填:粒子间碰撞的概率越大,化学反应速率越快;
④根据质量守恒定律可以知道,生成物的质量只与反应物的质量多少有关,而与反应物的浓度无关,所以本题中是向过氧化氢溶液中加入了水,而没有改变过氧化氢溶液中溶质的质量,所以产生氧气的质量不会改变;故填:不变;
⑤根据过氧化氢溶液中加入二氧化锰可以产生氧气的性质,取这瓶双氧水放入试管中,加入适量二氧化锰,如有气泡产生,说明没变质,否则就已变质.故填:取这瓶双氧水放入试管中,加入适量二氧化锰;没有气泡产生;
(3)①实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H22SO44)在常温下通过发生反应制得硫化氢气体,属于固液常温型,因此应该选取装置BC来制取硫化氢气体;
②因为硫化氢气体的密度比空气大,因此氯化氢气体应从m端进入,空气从n排出;用于洗气时长进,故n端连接g;
故答案为:①B;C;②n;g.
看了 通过对化学的学习,你已经掌握...的网友还看了以下:
用集气瓶可完成多种实验.请根据如下实验示意图,回答有关问题:(1)实验Ⅰ中进行的实验是,实验Ⅱ的集 2020-04-08 …
今天化学实验考查内容是“实验室制取氧气及氧气性质的验证”.实验一:制取氧气用双氧水、二氧化锰制取氧 2020-04-08 …
空气中氧气含量测定的再认识.实验回顾图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.(1)写 2020-05-02 …
空气中氧气含量测定的再认识.实验回顾图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.(1)写 2020-05-02 …
在化学实验中分别用氢气和一氧化碳还原氧化铜实验步骤的先后是什么?1.用氢气还原氧化铜时先,再.(选 2020-05-12 …
如图1所示是实验室制取和收集气体的装置,请按照要求作答:(1)实验室常用双氧水和二氧化锰制氧气,二 2020-05-13 …
二氧化碳、H2,甲烷、一氧化碳、氨气、氯气、硫化氮的实验室制取药品和化学方程式二氧化碳(1种)、H 2020-05-17 …
小明制取了两集气瓶的氧气,并分别进行硫、铁在氧气中燃烧的实验.(已知:每只集气瓶的容积为125毫升 2020-06-22 …
一氧气瓶的容积为0.08m3,开始时瓶中氧气的压强为20个大气压.某实验室每天消耗1个大气压的氧气0 2020-12-02 …
1.铜在空气中加热2.铜绿受热分解3.碳酸氢铵受热分解4.实验制加热高锰酸钾制氧气5.双氧水溶液与二 2021-02-16 …