早教吧作业答案频道 -->化学-->
工业上用NH3和CO2反应合成尿素.2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g)△H1=-536.1kJ/mol(1)该过程实际上分两步进行,第一步产生氨基甲酸铵,第二步是氨基甲酸铵脱水生成尿素.请写出
题目详情
工业上用NH3和CO2反应合成尿素.
2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g)△H1=-536.1kJ/mol
(1)该过程实际上分两步进行,第一步产生氨基甲酸铵,第二步是氨基甲酸铵脱水生成尿素.请写出第一步的反应方程式___.
(2)在一定条件下合成尿素,当氨碳比
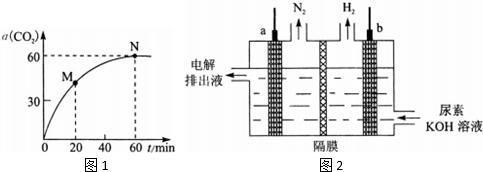
=4时,CO2的转化率随时间的变化关系如图1所示,下列说法错误的是___(填标号).
A.该反应在60min时达到平衡状态;
B.NH3的平衡转化率为70%;
C.增加氨碳比可进一步提高CO2的平衡转化率;
D.M点的逆反应速率v逆(CO2)大于N点的正反应速率v正(CO2);
(3)反应2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g),在200℃时可自发向正反应进行,则升高温度,平衡常数K___(填“增大”、“减小”、“不变”).
(4)若一定条件下得到的尿素为固体,2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),开始在一密闭容器中充入0.1mol NH3、0.65mol CO2、0.65mol H2O(g),保持温度不变,达到平衡时,混合气体的平均摩尔质量与起始相比___(填“变大”、“变小”、“不变”).
(5)尿素在一定温度和压力下会部分变为NH4CNO(氰酸铵),已知25℃氨水的电离常数为1.7×10-5,氰酸HCNO的电离常数为3.3×10-4.氰酸铵水溶液中各离子的浓度大小顺序为___.
(6)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图2(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).电解时,a极的电极反应式为___,若在b极产生标况下224mL氢气,则消耗尿素___g.32
322221

=4时,CO2的转化率随时间的变化关系如图1所示,下列说法错误的是___(填标号).
A.该反应在60min时达到平衡状态;
B.NH3的平衡转化率为70%;
C.增加氨碳比可进一步提高CO2的平衡转化率;
D.M点的逆反应速率v逆(CO2)大于N点的正反应速率v正(CO2);
(3)反应2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g),在200℃时可自发向正反应进行,则升高温度,平衡常数K___(填“增大”、“减小”、“不变”).
(4)若一定条件下得到的尿素为固体,2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),开始在一密闭容器中充入0.1mol NH3、0.65mol CO2、0.65mol H2O(g),保持温度不变,达到平衡时,混合气体的平均摩尔质量与起始相比___(填“变大”、“变小”、“不变”).
(5)尿素在一定温度和压力下会部分变为NH4CNO(氰酸铵),已知25℃氨水的电离常数为1.7×10-5,氰酸HCNO的电离常数为3.3×10-4.氰酸铵水溶液中各离子的浓度大小顺序为___.
(6)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图2(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).电解时,a极的电极反应式为___,若在b极产生标况下224mL氢气,则消耗尿素___g.
n(NH3) n(CO2) n(NH3) n(NH3) H3)H3)3) n(CO2) n(CO2) O2)O2)2)2
3
2
逆2正2
32222
32222322
4-5-4
22
2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g)△H1=-536.1kJ/mol

(1)该过程实际上分两步进行,第一步产生氨基甲酸铵,第二步是氨基甲酸铵脱水生成尿素.请写出第一步的反应方程式___.
(2)在一定条件下合成尿素,当氨碳比
| n(NH3) |
| n(CO2) |
A.该反应在60min时达到平衡状态;
B.NH3的平衡转化率为70%;
C.增加氨碳比可进一步提高CO2的平衡转化率;
D.M点的逆反应速率v逆(CO2)大于N点的正反应速率v正(CO2);
(3)反应2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g),在200℃时可自发向正反应进行,则升高温度,平衡常数K___(填“增大”、“减小”、“不变”).
(4)若一定条件下得到的尿素为固体,2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),开始在一密闭容器中充入0.1mol NH3、0.65mol CO2、0.65mol H2O(g),保持温度不变,达到平衡时,混合气体的平均摩尔质量与起始相比___(填“变大”、“变小”、“不变”).
(5)尿素在一定温度和压力下会部分变为NH4CNO(氰酸铵),已知25℃氨水的电离常数为1.7×10-5,氰酸HCNO的电离常数为3.3×10-4.氰酸铵水溶液中各离子的浓度大小顺序为___.
(6)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图2(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).电解时,a极的电极反应式为___,若在b极产生标况下224mL氢气,则消耗尿素___g.32
322221

| n(NH3) |
| n(CO2) |
A.该反应在60min时达到平衡状态;
B.NH3的平衡转化率为70%;
C.增加氨碳比可进一步提高CO2的平衡转化率;
D.M点的逆反应速率v逆(CO2)大于N点的正反应速率v正(CO2);
(3)反应2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g),在200℃时可自发向正反应进行,则升高温度,平衡常数K___(填“增大”、“减小”、“不变”).
(4)若一定条件下得到的尿素为固体,2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g),开始在一密闭容器中充入0.1mol NH3、0.65mol CO2、0.65mol H2O(g),保持温度不变,达到平衡时,混合气体的平均摩尔质量与起始相比___(填“变大”、“变小”、“不变”).
(5)尿素在一定温度和压力下会部分变为NH4CNO(氰酸铵),已知25℃氨水的电离常数为1.7×10-5,氰酸HCNO的电离常数为3.3×10-4.氰酸铵水溶液中各离子的浓度大小顺序为___.
(6)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图2(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).电解时,a极的电极反应式为___,若在b极产生标况下224mL氢气,则消耗尿素___g.
| n(NH3) |
| n(CO2) |
3
2
逆2正2
32222
32222322
4-5-4
22
▼优质解答
答案和解析
(1)该过程实际上分两步进行,第一步产生氨基甲酸铵,反应方程式为:2NH3(g)+CO2(g)⇌NH2COONH4,故答案为:2NH3(g)+CO2(g)⇌NH2COONH4;(2)A.从图象中可知0-60min二氧化碳的转化率始终增大,到60min后...
看了 工业上用NH3和CO2反应合...的网友还看了以下: