早教吧作业答案频道 -->化学-->
某化学兴趣小组在实验室利用氯气与石灰乳制取漂白粉.已知:氯气和碱的反应为放热反应.温度较高时,氯气和石灰乳还能发生如下反应:6Cl2+6Ca(OH)2△
题目详情
某化学兴趣小组在实验室利用氯气与石灰乳制取漂白粉.
已知:氯气和碱的反应为放热反应.温度较高时,氯气和石灰乳还能发生如下反应:6Cl2+6Ca(OH)2
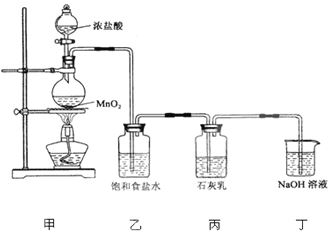
5CaCl2+Ca(ClO3)2+6H2O该兴趣小组设计了下列实验装置进行实验.
请回答下列问题:
(1)实验室用甲装置制备氯气,其反应的化学方程式是___.
(2)乙装置的作用是___;丁装置中发生反应的化学方程式___.
(3)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.可能原因有两个:
①部分氯气未与石灰乳反应而逸出;②___.
(4)已知浓盐酸和次氯酸钙也能反应产生氯气,写出该反应的化学方程式___;若用储存很久的漂白粉与浓盐酸制氯气,则可能含有的杂质气体有H2O、___.(填化学式)某化学兴趣小组在实验室利用氯气与石灰乳制取漂白粉.

已知:氯气和碱的反应为放热反应.温度较高时,氯气和石灰乳还能发生如下反应:6Cl2+6Ca(OH)2
5CaCl2+Ca(ClO3)2+6H2O该兴趣小组设计了下列实验装置进行实验.
请回答下列问题:
(1)实验室用甲装置制备氯气,其反应的化学方程式是___.
(2)乙装置的作用是___;丁装置中发生反应的化学方程式___.
(3)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.可能原因有两个:
①部分氯气未与石灰乳反应而逸出;②___.
(4)已知浓盐酸和次氯酸钙也能反应产生氯气,写出该反应的化学方程式___;若用储存很久的漂白粉与浓盐酸制氯气,则可能含有的杂质气体有H2O、___.(填化学式)

22
5CaCl2+Ca(ClO3)2+6H2O该兴趣小组设计了下列实验装置进行实验.
请回答下列问题:
(1)实验室用甲装置制备氯气,其反应的化学方程式是___.
(2)乙装置的作用是___;丁装置中发生反应的化学方程式___.
(3)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.可能原因有两个:
①部分氯气未与石灰乳反应而逸出;②___.
(4)已知浓盐酸和次氯酸钙也能反应产生氯气,写出该反应的化学方程式___;若用储存很久的漂白粉与浓盐酸制氯气,则可能含有的杂质气体有H2O、___.(填化学式)
△ △ △ 2322
2
2

已知:氯气和碱的反应为放热反应.温度较高时,氯气和石灰乳还能发生如下反应:6Cl2+6Ca(OH)2
| ||
请回答下列问题:
(1)实验室用甲装置制备氯气,其反应的化学方程式是___.
(2)乙装置的作用是___;丁装置中发生反应的化学方程式___.
(3)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.可能原因有两个:
①部分氯气未与石灰乳反应而逸出;②___.
(4)已知浓盐酸和次氯酸钙也能反应产生氯气,写出该反应的化学方程式___;若用储存很久的漂白粉与浓盐酸制氯气,则可能含有的杂质气体有H2O、___.(填化学式)某化学兴趣小组在实验室利用氯气与石灰乳制取漂白粉.

已知:氯气和碱的反应为放热反应.温度较高时,氯气和石灰乳还能发生如下反应:6Cl2+6Ca(OH)2
| ||
请回答下列问题:
(1)实验室用甲装置制备氯气,其反应的化学方程式是___.
(2)乙装置的作用是___;丁装置中发生反应的化学方程式___.
(3)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.可能原因有两个:
①部分氯气未与石灰乳反应而逸出;②___.
(4)已知浓盐酸和次氯酸钙也能反应产生氯气,写出该反应的化学方程式___;若用储存很久的漂白粉与浓盐酸制氯气,则可能含有的杂质气体有H2O、___.(填化学式)

22
| ||
请回答下列问题:
(1)实验室用甲装置制备氯气,其反应的化学方程式是___.
(2)乙装置的作用是___;丁装置中发生反应的化学方程式___.
(3)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.可能原因有两个:
①部分氯气未与石灰乳反应而逸出;②___.
(4)已知浓盐酸和次氯酸钙也能反应产生氯气,写出该反应的化学方程式___;若用储存很久的漂白粉与浓盐酸制氯气,则可能含有的杂质气体有H2O、___.(填化学式)
| ||
| △ |
| . |
| △ |
| . |
| △ |
| . |
| △ |
| . |
.
.
.
.
2
2
▼优质解答
答案和解析
(1)实验室制取氯气是用浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水,反应的化学方程式为:MnO22+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,氯气在食盐水中不溶,氯化氢易溶,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,氢氧化钠和氯气反应Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:除去氯气中混有的氯化氢;Cl2+2NaOH═NaCl+NaClO+H2O;
(3)在反应过程中部分氯气未与石灰乳反应而逸出导致产物中Ca(ClO)2的质量明显小于理论值或温度较高时发生了反应6Cl2+6Ca(OH)2
5CaCl2+Ca(ClO3)2+6H2O生成Ca(ClO3)2,
故答案为:反应过程温度升高,有Ca(ClO3)2生成;
(4)浓盐酸和次氯酸钙发生氧化还原反应,氯价态归中,生成氯气,反应为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气),
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O; HCl、CO2.
△ △ △ △ MnCl22+Cl22↑+2H22O,
故答案为:MnO22+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,氯气在食盐水中不溶,氯化氢易溶,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,氢氧化钠和氯气反应Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:除去氯气中混有的氯化氢;Cl2+2NaOH═NaCl+NaClO+H2O;
(3)在反应过程中部分氯气未与石灰乳反应而逸出导致产物中Ca(ClO)2的质量明显小于理论值或温度较高时发生了反应6Cl2+6Ca(OH)2
5CaCl2+Ca(ClO3)2+6H2O生成Ca(ClO3)2,
故答案为:反应过程温度升高,有Ca(ClO3)2生成;
(4)浓盐酸和次氯酸钙发生氧化还原反应,氯价态归中,生成氯气,反应为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气),
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O; HCl、CO2.
△ △ △ △ MnCl22+Cl22↑+2H22O;
(2)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,氯气在食盐水中不溶,氯化氢易溶,所以通过饱和食盐水的作用是除去Cl22中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,氢氧化钠和氯气反应Cl22+2NaOH═NaCl+NaClO+H22O,
故答案为:除去氯气中混有的氯化氢;Cl22+2NaOH═NaCl+NaClO+H22O;
(3)在反应过程中部分氯气未与石灰乳反应而逸出导致产物中Ca(ClO)22的质量明显小于理论值或温度较高时发生了反应6Cl22+6Ca(OH)22
5CaCl2+Ca(ClO3)2+6H2O生成Ca(ClO3)2,
故答案为:反应过程温度升高,有Ca(ClO3)2生成;
(4)浓盐酸和次氯酸钙发生氧化还原反应,氯价态归中,生成氯气,反应为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气),
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O; HCl、CO2.
△ △ △ △ 5CaCl22+Ca(ClO33)22+6H22O生成Ca(ClO33)22,
故答案为:反应过程温度升高,有Ca(ClO33)22生成;
(4)浓盐酸和次氯酸钙发生氧化还原反应,氯价态归中,生成氯气,反应为:Ca(ClO)22+4HCl(浓)═CaCl22+2Cl22↑+2H22O,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生CaCO33+2HCl=CaCl22+CO22↑+H22O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO22、HCl、H22O(气),
故答案为:Ca(ClO)22+4HCl(浓)═CaCl22+2Cl22↑+2H22O; HCl、CO22.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,氯气在食盐水中不溶,氯化氢易溶,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,氢氧化钠和氯气反应Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:除去氯气中混有的氯化氢;Cl2+2NaOH═NaCl+NaClO+H2O;
(3)在反应过程中部分氯气未与石灰乳反应而逸出导致产物中Ca(ClO)2的质量明显小于理论值或温度较高时发生了反应6Cl2+6Ca(OH)2
| ||
故答案为:反应过程温度升高,有Ca(ClO3)2生成;
(4)浓盐酸和次氯酸钙发生氧化还原反应,氯价态归中,生成氯气,反应为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气),
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O; HCl、CO2.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.故答案为:MnO22+4HCl(浓)
| ||
(2)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,氯气在食盐水中不溶,氯化氢易溶,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,氢氧化钠和氯气反应Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:除去氯气中混有的氯化氢;Cl2+2NaOH═NaCl+NaClO+H2O;
(3)在反应过程中部分氯气未与石灰乳反应而逸出导致产物中Ca(ClO)2的质量明显小于理论值或温度较高时发生了反应6Cl2+6Ca(OH)2
| ||
故答案为:反应过程温度升高,有Ca(ClO3)2生成;
(4)浓盐酸和次氯酸钙发生氧化还原反应,氯价态归中,生成氯气,反应为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气),
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O; HCl、CO2.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.(2)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,氯气在食盐水中不溶,氯化氢易溶,所以通过饱和食盐水的作用是除去Cl22中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,氢氧化钠和氯气反应Cl22+2NaOH═NaCl+NaClO+H22O,
故答案为:除去氯气中混有的氯化氢;Cl22+2NaOH═NaCl+NaClO+H22O;
(3)在反应过程中部分氯气未与石灰乳反应而逸出导致产物中Ca(ClO)22的质量明显小于理论值或温度较高时发生了反应6Cl22+6Ca(OH)22
| ||
故答案为:反应过程温度升高,有Ca(ClO3)2生成;
(4)浓盐酸和次氯酸钙发生氧化还原反应,氯价态归中,生成氯气,反应为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生CaCO3+2HCl=CaCl2+CO2↑+H2O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO2、HCl、H2O(气),
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O; HCl、CO2.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.故答案为:反应过程温度升高,有Ca(ClO33)22生成;
(4)浓盐酸和次氯酸钙发生氧化还原反应,氯价态归中,生成氯气,反应为:Ca(ClO)22+4HCl(浓)═CaCl22+2Cl22↑+2H22O,贮存很久的漂白粉可能存在碳酸钙,加盐酸发生CaCO33+2HCl=CaCl22+CO22↑+H22O,浓盐酸易挥发,从溶液中生成的气体中会混有水蒸气,则制得的氯气中,可能含有杂质气体为CO22、HCl、H22O(气),
故答案为:Ca(ClO)22+4HCl(浓)═CaCl22+2Cl22↑+2H22O; HCl、CO22.
看了 某化学兴趣小组在实验室利用氯...的网友还看了以下:
某化学兴趣小组在实验室利用氯气与石灰乳制取漂白粉.已知:氯气和碱的反应为放热反应.温度较高时,氯气 2020-04-07 …
石灰法是目前应用最广泛的工业废气脱硫方法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在 2020-06-16 …
已知:反应CaCO3(s)=CaO(s,生石灰)+CO2(g)△H(298K)=+178.3kJ• 2020-07-18 …
煤中含有硫,燃烧时会产生有害的SO2,用生石灰可以消除SO2,减少污染,其反应为CaO(s)+SO 2020-07-20 …
氨气是重要的化工原料.(1)实验室可用浓氨水和(选填编号)快速制取氨气.a.烧碱b.生石灰c.氯化 2020-07-22 …
工业用石灰石浆吸收废气中的二氧化硫,并制取石膏(主要成分为硫酸钙).简易流程如图,主要的反应为:2C 2020-11-05 …
为什么还要2CaSO3+O2=2CaSO4,石灰法是目前应用最广泛的工业废气脱硫方法,通过煅烧石灰石 2020-11-22 …
工业用石灰石浆吸收废气中的二氧化硫,并制取石膏(主要成分为硫酸钙).简易流程如右图,主要的反应为:2 2020-11-25 …
实验室中用石灰石(主要成分是CaCO3)与稀盐酸制CO2,发生的反应为:实验室中用石灰石(主要成分是 2021-02-06 …
硅,二氧化硅难溶于水,不能与盐酸反应.为了测定该石灰石的纯度,兴趣小组同学取用4g这种石灰石样品,用 2021-02-06 …