早教吧作业答案频道 -->化学-->
某学生对SO2与漂粉精的反应进行实验探究:操作现象取适量漂粉精固体,加入100mL水部分固体溶解,溶液略有颜色过滤,测漂粉精溶液的pHpH试纸先变蓝,后褪色
题目详情
某学生对SO2与漂粉精的反应进行实验探究:
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式___;
(2)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是___;
②由实验a、b不能判断白雾中含有HC1,理由是___;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是___
②用离子方程式解释现象iii中黄绿色褪去的原因:___.
(4)测定漂粉精有效成分的质量分数.称取2.000g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000mol•L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3C1O-+I-═3C1-+IO3-IO3-+5I-+3H2O═6OH-+3I2
实验测得数据如下表所示.
该漂白粉中有效成分的质量分数为___.
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
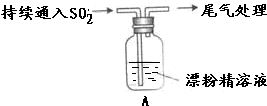 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(2)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是___;
②由实验a、b不能判断白雾中含有HC1,理由是___;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是___
②用离子方程式解释现象iii中黄绿色褪去的原因:___.
(4)测定漂粉精有效成分的质量分数.称取2.000g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000mol•L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3C1O-+I-═3C1-+IO3-IO3-+5I-+3H2O═6OH-+3I2
实验测得数据如下表所示.
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
▼优质解答
答案和解析
(1)Cl2和Ca(OH)2反应生成氯化钙、次氯酸钙和水,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)由现象可知,次氯酸钙与二氧化硫发生氧化还原反应,液面上方出现白雾,白雾中含有HCl,溶液中含氯离子,则
a.用湿润的碘化钾淀粉试纸检验白雾,无变化,则没有氯气生成;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀,沉淀可能为AgCl,也可能为Ag2SO4或Ag2SO3,
①实验a目的是验证Cl2是否存在,
故答案为:验证Cl2是否存在;
②由实验a、b不能判断白雾中含有HC1,理由是与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3,
故答案为:与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3;
(3)①CaSO4与盐酸不反应,与氯化钡反应生成硫酸钡沉淀,则则沉淀X中含有的物质是CaSO4,
故答案为:CaSO4;
②氯气与二氧化硫可发生氧化还原反应,黄绿色褪去,则离子方程式解释现象iii中黄绿色褪去的原因为SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(4)由3ClO-+I-=3Cl-+IO3- ①、IO3-+5I-+3H2O=6OH-+3I2②可知,
将方程式①+②得:ClO-+2I-+H2O=Cl-+2OH-+I2,由滴定实验可知,消耗KI溶液的体积为(19.98+20.02+20.00)mL×
=20.00mL,
设次氯酸根离子的物质的量为x,
ClO-+2I-+H2O=Cl-+2OH-+I2
1mol 2mol
x 0.2000mol•L-1×0.020L
所以x=0.002mol,
次氯酸钙的质量为:143g/mol×
×0.002mol=0.143g,
该漂白粉中有效成分的质量分数为
×100%=7.15%,
故答案为:7.15%.
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)由现象可知,次氯酸钙与二氧化硫发生氧化还原反应,液面上方出现白雾,白雾中含有HCl,溶液中含氯离子,则
a.用湿润的碘化钾淀粉试纸检验白雾,无变化,则没有氯气生成;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀,沉淀可能为AgCl,也可能为Ag2SO4或Ag2SO3,
①实验a目的是验证Cl2是否存在,
故答案为:验证Cl2是否存在;
②由实验a、b不能判断白雾中含有HC1,理由是与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3,
故答案为:与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3;
(3)①CaSO4与盐酸不反应,与氯化钡反应生成硫酸钡沉淀,则则沉淀X中含有的物质是CaSO4,
故答案为:CaSO4;
②氯气与二氧化硫可发生氧化还原反应,黄绿色褪去,则离子方程式解释现象iii中黄绿色褪去的原因为SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(4)由3ClO-+I-=3Cl-+IO3- ①、IO3-+5I-+3H2O=6OH-+3I2②可知,
将方程式①+②得:ClO-+2I-+H2O=Cl-+2OH-+I2,由滴定实验可知,消耗KI溶液的体积为(19.98+20.02+20.00)mL×
| 1 |
| 3 |
设次氯酸根离子的物质的量为x,
ClO-+2I-+H2O=Cl-+2OH-+I2
1mol 2mol
x 0.2000mol•L-1×0.020L
所以x=0.002mol,
次氯酸钙的质量为:143g/mol×
| 1 |
| 2 |
该漂白粉中有效成分的质量分数为
| 0.143g |
| 2.000g |
故答案为:7.15%.
看了某学生对SO2与漂粉精的反应进...的网友还看了以下:
二进制转十进制这样计算对吗《1000001000》0*2^0+0*2^1+0*2^2+1*2^3+ 2020-04-07 …
大家快来看看这几道题怎么简算!我急用!0.071*1234+0.71*567.6+7.1*23.4 2020-05-16 …
已知二次函数f(x)=ax^2+bx+c的导数为f'(x),f'(x)>0.对任意实数x,有f(x 2020-05-17 …
计算题:要度量某软件的质量要素F6(可维护性),假设C63=0.1,C66=0.2,C610=0.2 2020-05-31 …
直接写得数.1.2+0.3=4+0.6=12.9-5=12+3.5=0.9+0.7=0.6+1.4 2020-07-19 …
一个底数为二次函数的对数方程,定义域是R一个真数为二次函数的对数方程,定义域是R,为什么要真数的△ 2020-07-30 …
环数ξ=4,概率P=0.02,环数5=0.04,P=0.04..n次射击后为什么书上写预计有大约P( 2020-10-30 …
一.计算题(一)直接写出得数:0.3+0.57=0.54÷6=2.2×5+9=2.4×0.5=8-0 2020-11-17 …
一只电流表有“0~0.63”和“0~33”两个量程,某次实验中用的是“0~0.63”的量程上的刻度盘 2020-12-05 …
数据偏差范围中%的使用,是40±2.0%对还是40%±2.0对不知道哪个写法是对的,或者应该是40% 2021-01-02 …