早教吧作业答案频道 -->化学-->
碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:①CH3OH(g)⇌CO(g)+2H2(g)△H2=+90.8kJ/mol②CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H2=+49kJ/mol③C
题目详情
碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
①CH3OH(g)⇌CO(g)+2H2(g)△H2=+90.8kJ/mol
②CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H2=+49kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
请回答下列问题:
(1)△H3=___.
(2)温度升高对反应②的影响是___.
(3)甲醇使用不当会导致污染,可用电解法消除这种污染.其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2.
①电解时,阳极的电极反应式为___.
②Co3+氧化CH3OH的离子方程式为___.
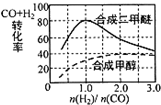
(4)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:
3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
的变化如图所示:
①合成二甲醚的最佳氢碳比为___.
②对于气相反应,用某组分B的平衡分压PB代替物质的量浓度c(B)也可以表示平衡常数(记作KP),水煤气合成二甲醚反应的平衡常数KP表达式为___.
(5)在标态(反应物和产物都处于100kPa)和T(K)条件下由稳定单质生成1mol化合物的焓变称为该物质在T(K)时的标准焓,用符号△H0表示.已知石墨和一氧化碳的燃烧热△H分别为-393.5kJ/mol和-283.0kJ/mol,则CO(g)的△H0为___.
①CH3OH(g)⇌CO(g)+2H2(g)△H2=+90.8kJ/mol
②CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H2=+49kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
请回答下列问题:

(1)△H3=___.
(2)温度升高对反应②的影响是___.
(3)甲醇使用不当会导致污染,可用电解法消除这种污染.其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2.
①电解时,阳极的电极反应式为___.
②Co3+氧化CH3OH的离子方程式为___.
(4)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:
3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
| n(H2) |
| n(CO) |
①合成二甲醚的最佳氢碳比为___.
②对于气相反应,用某组分B的平衡分压PB代替物质的量浓度c(B)也可以表示平衡常数(记作KP),水煤气合成二甲醚反应的平衡常数KP表达式为___.
(5)在标态(反应物和产物都处于100kPa)和T(K)条件下由稳定单质生成1mol化合物的焓变称为该物质在T(K)时的标准焓,用符号△H0表示.已知石墨和一氧化碳的燃烧热△H分别为-393.5kJ/mol和-283.0kJ/mol,则CO(g)的△H0为___.
▼优质解答
答案和解析
(1)CH3OH(g)⇌CO(g)+2H2(g)△H2=+90.8kJ/mol
②CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H2=+49kJ/mol
依据盖斯定律计算②-①得到③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.8 kJ/mol,
故答案为:-41.8 kJ/mol;
(2)CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H2=+49kJ/mol,反应是气体体积增大的吸热反应,升高温度反应速率加快,升高温度有利于反应②向正反应方向移动,
故答案为:反应速率加快,有利于向正反应方向移动;
(3)①其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2.
电解池中该电极上发生失电子的氧化反应,电极反应为:Co2+-e-═Co3+,
故答案为:Co2+-e-═Co3+;
②Co3+将甲醇氧化为二氧化碳,本身被还原为Co,即6Co3++CH3OH+H2O═CO2↑+6Co2++6H+,故答案为:6Co3++CH3OH+H2O═CO2↑+6Co2++6 H+;
(3)①Co2+-e-═Co3+;
②6 Co3++CH3OH+H2O═CO2↑+6 Co2++6 H+(2分)
(4)①3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),图象分析可知在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比1:1,
故答案为:1:1;
②3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),反应的平衡常数KP表达式为生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积
,
故答案为:
;
(5)石墨和一氧化碳的燃烧热△H分别为-393.5kJ/mol和-283.0kJ/mol,的燃烧热的热化学方程式为
①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②CO(g)+
O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律计算①-②,得到C(s)+
O2(g)═CO(g)△H0=-110.5 kJ/mol,
CO(g)的△H0为-110.5 kJ/mol,
故答案为:-110.5 kJ/mol.
②CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H2=+49kJ/mol
依据盖斯定律计算②-①得到③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.8 kJ/mol,
故答案为:-41.8 kJ/mol;
(2)CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H2=+49kJ/mol,反应是气体体积增大的吸热反应,升高温度反应速率加快,升高温度有利于反应②向正反应方向移动,
故答案为:反应速率加快,有利于向正反应方向移动;
(3)①其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2.
电解池中该电极上发生失电子的氧化反应,电极反应为:Co2+-e-═Co3+,
故答案为:Co2+-e-═Co3+;
②Co3+将甲醇氧化为二氧化碳,本身被还原为Co,即6Co3++CH3OH+H2O═CO2↑+6Co2++6H+,故答案为:6Co3++CH3OH+H2O═CO2↑+6Co2++6 H+;
(3)①Co2+-e-═Co3+;
②6 Co3++CH3OH+H2O═CO2↑+6 Co2++6 H+(2分)
(4)①3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),图象分析可知在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比1:1,
故答案为:1:1;
②3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),反应的平衡常数KP表达式为生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积
| p(CH3OCH3)p(CO2) |
| p3(H2)p3(CO) |
故答案为:
| p(CH3OCH3)p(CO2) |
| p3(H2)p3(CO) |
(5)石墨和一氧化碳的燃烧热△H分别为-393.5kJ/mol和-283.0kJ/mol,的燃烧热的热化学方程式为
①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②CO(g)+
| 1 |
| 2 |
依据盖斯定律计算①-②,得到C(s)+
| 1 |
| 2 |
CO(g)的△H0为-110.5 kJ/mol,
故答案为:-110.5 kJ/mol.
看了碳和碳的化合物在生产、生活中有...的网友还看了以下:
“壳”的读音‘壳’有两个读音,qiào和ké,两个都是‘坚硬的外皮’的意思,那么,应该何时读qià 2020-04-05 …
英语单词辨音找出画()部分读音与其余不同的单词()1.A .kn(ee) B.n(e)ck C.r 2020-05-17 …
急1天答好多多多多给20分越快越好用k,o,n,h,g,n,o,g组单词look!your(--- 2020-05-20 …
找出发音相同的单词opposite中第二个o发音相同的是:A.c[o]mpanion[kəmˈpæ 2020-06-06 …
证明题!如果a是f′′′(x)的一个k重跟,证明g(x)=(x-a)/2[f′(x)+f′(a)] 2020-06-12 …
如果令A、B、C、D……X、Y、Z这26个英文字母,分别等于百分之1、2、3、4、……HARDWO 2020-07-09 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
三元一次方程组a*x+b*y+c*z+d=0,e*x+f*y+g*z+h=0,i*x+j*y+k* 2020-08-03 …
无穷级数的求解t取1到正无穷1、∑1/(1+k)^t=1/k;2、∑(1+g)^t/(1+k)^t, 2020-10-31 …
如果令A、B、C、D……X、Y、Z这26个英文字母,分别等于百分之1、2、3、4、……HARDWOR 2021-02-09 …