早教吧作业答案频道 -->化学-->
配合物在工农业生产和科学研究中具有重要的作用.Ⅰ.向含CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,
题目详情
配合物在工农业生产和科学研究中具有重要的作用.
Ⅰ.向含CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,会析出[Cu(NH3)4]SO4•H2O晶体.
(1)Cu2+的价电子排布图为:___; NH3的VSEPR模型为___;请解释加入乙醇后析出晶体的原因___.
(3)乙二胺(H2N-CH2-CH2-NH2)也可与CuCl2溶液形成配离子,请写出标有配位键的该配离子的结构式___.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___.
Ⅱ.配合物Na2[Fe(CN)5(NO)]可用于离子检验.
(4)配合物中碳元素有金刚石、石墨等多种同素异形体.
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm.其原因___.
②石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图甲所示,M原子位于晶胞的棱上与内部,该材料的化学式为___.
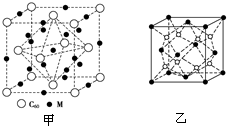
③配合物中电负性最大的元素和电离能最小的元素形成的一种离子化合物的晶胞结构如图乙,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___.已知该晶胞的密度为ρg•cm-3,阿伏加德罗常数为NA,求晶胞边长a=___cm(用含ρ、NA的计算式表示).
④配合物中位于同一周期的三种元素中的两种,能形成原子个数比为1:3的常见微粒,推测与这两种微粒互为等电子体的微粒___.
Ⅰ.向含CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,会析出[Cu(NH3)4]SO4•H2O晶体.
(1)Cu2+的价电子排布图为:___; NH3的VSEPR模型为___;请解释加入乙醇后析出晶体的原因___.
(3)乙二胺(H2N-CH2-CH2-NH2)也可与CuCl2溶液形成配离子,请写出标有配位键的该配离子的结构式___.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___.
Ⅱ.配合物Na2[Fe(CN)5(NO)]可用于离子检验.
(4)配合物中碳元素有金刚石、石墨等多种同素异形体.
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm.其原因___.
②石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图甲所示,M原子位于晶胞的棱上与内部,该材料的化学式为___.

③配合物中电负性最大的元素和电离能最小的元素形成的一种离子化合物的晶胞结构如图乙,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___.已知该晶胞的密度为ρg•cm-3,阿伏加德罗常数为NA,求晶胞边长a=___cm(用含ρ、NA的计算式表示).
④配合物中位于同一周期的三种元素中的两种,能形成原子个数比为1:3的常见微粒,推测与这两种微粒互为等电子体的微粒___.
▼优质解答
答案和解析
(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为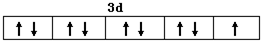 ,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+
,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+
(5-3×1)=4,VSEPR模型为正四面体结构;根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度,
故答案为:
故答案为: ; 正四面体;乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度;
; 正四面体;乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度;
(3)配位键由含有孤电子对的原子指向含有空轨道的原子,中心原子铜原子具有空轨道,N原子含有孤电子对,所以该配合物中的配位键为: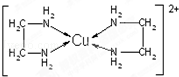 ,分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,由于氢键的作用力比范德华力大,故乙二胺的沸点较高,
,分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,由于氢键的作用力比范德华力大,故乙二胺的沸点较高,
故答案为: ;乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高;
;乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高;
(4)①金刚石中碳原子以sp3杂化,形成四条杂化轨道,全部形成σ键;石墨中碳原子以sp2杂化,形成三条杂化轨道,还有一条为杂化的p轨道,三条杂化轨道形成σ键,而未杂化p轨道形成π键,所以石墨的C-C键的键长短,
故答案为:是金刚石中C-C间只存在σ共价键,而石墨层内的C-C间不仅存在σ共价键,还有大π键;
②M原子位于晶胞的棱上与内部,棱上有12个M,内部有9个M,其个数为12×
+9=12,C60分子位于顶点和面心,C60分子的个数为8×
+6×
=4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,
故答案为:M3C60;
③根据晶胞(Na2O)结构可知N(Na+):N(O2-)=2:1,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体(立方体);该晶胞中含有4个阴离子,所以有有
=4,解得a=
.
故答案为:正方体(立方体);
;
④甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,SO3或BF3或BCl3的原子数都为4,价电子数都为24,属于等电子体,
故答案为:SO3或BF3或BCl3.
 ,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+
,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+| 1 |
| 2 |
故答案为:
故答案为:
 ; 正四面体;乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度;
; 正四面体;乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度;(3)配位键由含有孤电子对的原子指向含有空轨道的原子,中心原子铜原子具有空轨道,N原子含有孤电子对,所以该配合物中的配位键为:
 ,分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,由于氢键的作用力比范德华力大,故乙二胺的沸点较高,
,分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,由于氢键的作用力比范德华力大,故乙二胺的沸点较高,故答案为:
 ;乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高;
;乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高;(4)①金刚石中碳原子以sp3杂化,形成四条杂化轨道,全部形成σ键;石墨中碳原子以sp2杂化,形成三条杂化轨道,还有一条为杂化的p轨道,三条杂化轨道形成σ键,而未杂化p轨道形成π键,所以石墨的C-C键的键长短,
故答案为:是金刚石中C-C间只存在σ共价键,而石墨层内的C-C间不仅存在σ共价键,还有大π键;
②M原子位于晶胞的棱上与内部,棱上有12个M,内部有9个M,其个数为12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:M3C60;
③根据晶胞(Na2O)结构可知N(Na+):N(O2-)=2:1,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体(立方体);该晶胞中含有4个阴离子,所以有有
| a3×ρ×NA |
| 62 |
| 3 |
| ||
故答案为:正方体(立方体);
| 3 |
| ||
④甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,SO3或BF3或BCl3的原子数都为4,价电子数都为24,属于等电子体,
故答案为:SO3或BF3或BCl3.
看了 配合物在工农业生产和科学研究...的网友还看了以下:
为了除去Nacl溶液中少量Cacl2和Na3so4,现按下列步骤进行试验(1)向含杂质的Nacl溶 2020-05-13 …
分解水中蓝色的水,水中含有什么成份现在市面上卖的净水机出来的水有自清功能,水中加入蓝色的墨水它能使 2020-05-13 …
急求糕点翻译1.香橙之恋 清淡低脂的鲜奶油搭配酸甜的香橙果肉让您感觉入口即化...2.巧克力物 2020-05-16 …
下列表示对应化学反应的离子方程式正确的是A. 用KIO3 氧化酸性溶液中的KI: 5I-+IO3- 2020-05-16 …
将6.2g铁矿石(主要Fe2o3)投入适量盐酸中充分反应,过滤,在滤液中加过量NaOH溶液,充分反 2020-06-05 …
向50mlNa2SO4和Na2CO3的混合溶液中加过量BaCL2溶液得到14.51g白色沉淀,向白 2020-07-17 …
AL3+和NAOH反应生成什么?高人给个关于AL,AL3+,ALO2-的网络图吧```还有就是AL 2020-07-24 …
无机推断某化合物A是紫色晶体,化合物B是浅绿色晶体.将A、B混合溶于稀H2SO4中得黄棕色溶液C, 2020-07-29 …
为什么在自来水中加入蓝墨水,静置一段时间后,蓝色消失了一开始变得均一,后来颜色就消失了 2021-01-06 …
下列指定反应的离子方程式正确的是()A.向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+ 2021-02-12 …