早教吧作业答案频道 -->化学-->
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液
题目详情
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:___.
(2)在室温下,向0.02mol•L-1的Na2CrO4溶液中滴加0.01mol•L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,在此转化过程中,各物质浓度变化如图所示:该温度下,反应的平衡常数K=___
(3)Ag2CrO4为砖红色沉淀,以2~3滴K2CrO4为指示剂,用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-).Ag2CrO4、AgCl的KSP分别为9.0×10-12和1.56×10-10.滴定过程中首先析出沉淀为___,达到滴定终点的实验现象是___.
(4)该沉淀滴定要控制K2CrO4的浓度和溶液的PH值,其PH范围应在6.5~10.5,若PH<6.5实验结果偏高.请用平衡移动原理分析为什么结果会偏高.___.
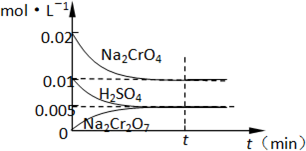
(2)在室温下,向0.02mol•L-1的Na2CrO4溶液中滴加0.01mol•L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,在此转化过程中,各物质浓度变化如图所示:该温度下,反应的平衡常数K=___
(3)Ag2CrO4为砖红色沉淀,以2~3滴K2CrO4为指示剂,用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-).Ag2CrO4、AgCl的KSP分别为9.0×10-12和1.56×10-10.滴定过程中首先析出沉淀为___,达到滴定终点的实验现象是___.
(4)该沉淀滴定要控制K2CrO4的浓度和溶液的PH值,其PH范围应在6.5~10.5,若PH<6.5实验结果偏高.请用平衡移动原理分析为什么结果会偏高.___.

▼优质解答
答案和解析
(1)Cr2O72-被Fe2+还原成Cr3+,Fe2+被氧化为Fe3+,其反应离子方程式为:Cr2O72-+6 Fe2++14H+=6 Fe3++2 Cr3++7 H2O,
故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
(2)CrO42-在酸性条件下转化为Cr2O72-,其反应的方程式为:2CrO42-+2H+⇌Cr2O72-+H2O;化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,因此K=
=
=5×1011(mol•L-1)-3;
故答案为:5×1011(mol•L-1)-3;
(3)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,设Na2CrO4和NaCl的浓度都为1mol/L,Ag2CrO4沉淀时需要的c(Ag+)=
=3×10-6,AgCl沉淀时需要的c(Ag+)=1.56×10-10,则AgCl先沉淀;
滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;
故答案为:AgCl;加入最后一滴AgNO3溶液出现砖红色沉淀;
(4)由于存在2CrO42-+2H+⇌Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动,c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大,
故答案为:由于存在2CrO42-+2 H+⇌Cr2O72-+H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP,c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大.
故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
(2)CrO42-在酸性条件下转化为Cr2O72-,其反应的方程式为:2CrO42-+2H+⇌Cr2O72-+H2O;化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,因此K=
| c(Cr2O72-) |
| C2(CrO42-)×C2(H+) |
| 5×10-3 |
| (1×10-2)4 |
故答案为:5×1011(mol•L-1)-3;
(3)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,设Na2CrO4和NaCl的浓度都为1mol/L,Ag2CrO4沉淀时需要的c(Ag+)=
| 9.0×10-12 |
滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;
故答案为:AgCl;加入最后一滴AgNO3溶液出现砖红色沉淀;
(4)由于存在2CrO42-+2H+⇌Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动,c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大,
故答案为:由于存在2CrO42-+2 H+⇌Cr2O72-+H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP,c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大.
看了(1)工业酸性废水中含Cr2O...的网友还看了以下:
向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全生成物是一水合氨还是氨气和水1向 2020-04-12 …
题目说、除去粗盐中SO42-可以用、Ba(OH)2或者、BaCl、不能用Ba(NO3)2、因为使用 2020-04-25 …
已知20℃时Fe(OH)3的溶解度是3×10-9g,难溶于水,在pH=7~8时可将Fe3+完全生成 2020-05-13 …
水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性(KOH)KI溶液,生成MnO(O 2020-06-30 …
兴趣小组实验中,将NaOH溶液滴入CuSO4溶液中,结果溶液中生成了浅绿色的固体.于是,他们对该浅 2020-07-10 …
在工业废渣中回收钴中,在酸性条件下,加碳酸钙除铁,反应原理是什么?如果生成Fe(OH)3,那么里面 2020-07-25 …
Al(OH)2Cl可净水.(1)Al(OH)2Cl中氯元素的化合价为.(2)AlCl3溶液中加入N 2020-07-29 …
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化 2020-11-02 …
工业上处理含Cr2O72-(重铬酸根离子)的废水,采用以下方法:往废水中加入适量的氯化钠,以铁为电极 2020-12-16 …
已知某混合溶液由HCl,K2CO3,H2SO4,CuCl2中的两种混合而成,向该溶液中加入Ba(OH 2021-02-01 …