早教吧作业答案频道 -->化学-->
已知砷(As)元素的原子结构示意图为:(1)砷在元素周期表中位于第周期,最高正化合价为.(2)已知可逆反应AsO43-+2I-+2H+⇌AsO33-+I2+H2.如图所示,若A中盛KI和I2溶液,B中盛Na3AsO4和
题目详情
已知砷(As)元素的原子结构示意图为: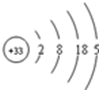
(1)砷在元素周期表中位于第___ 周期,最高正化合价为___.
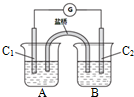
(2)已知可逆反应AsO43-+2I-+2H+⇌AsO33-+I2+H2.如图所示,若A中盛KI和I2溶液,B中盛Na3AsO4和Na3AsO3溶液,C1、C2为两根碳棒.当向B中滴加浓盐酸时,发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转.
①加盐酸时,上述平衡向___移动,C1是___极(填“正”或“负”);
②写出加NaOH溶液时,C2上发生的电极反应式.
(3)As2O3俗名砒霜,是一种剧毒物质.法医检验砒霜中毒的方法是:向试样中加入锌粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷镜”,这就是著名的“马氏验砷法”.请将下面方程式补充完整并配平:
□As2O3+□Zn+□HCl═□AsH3+□ZnCl2+□___.


(1)砷在元素周期表中位于第___ 周期,最高正化合价为___.
(2)已知可逆反应AsO43-+2I-+2H+⇌AsO33-+I2+H2.如图所示,若A中盛KI和I2溶液,B中盛Na3AsO4和Na3AsO3溶液,C1、C2为两根碳棒.当向B中滴加浓盐酸时,发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转.
①加盐酸时,上述平衡向___移动,C1是___极(填“正”或“负”);
②写出加NaOH溶液时,C2上发生的电极反应式.
(3)As2O3俗名砒霜,是一种剧毒物质.法医检验砒霜中毒的方法是:向试样中加入锌粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷镜”,这就是著名的“马氏验砷法”.请将下面方程式补充完整并配平:
□As2O3+□Zn+□HCl═□AsH3+□ZnCl2+□___.
▼优质解答
答案和解析
(1)电子层等于周期序数,4个电子层,所以周期数为:四,最外层有5个电子,所以最高正价为+5,故答案为:四;+5;
(2)①加盐酸时,可逆反应AsO43-+2I-+2H+⇌AsO33-+I2+H2O,氢离子的浓度变大,平衡正向移动,A中碘离子发生氧化反应为负极,所以C1为负极,
故答案为:右(正反应); 负;
②加NaOH溶液时平衡逆向移动,该过程中C2棒为负极失电子发生氧化反应,电极反应为AsO33-+2OH--2e-=AsO43-+H2O,
故答案为:AsO33-+2OH--2e-=AsO43-+H2O;
(3)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式As2O3+12HCl+6Zn=6ZnCl2+2AsH3↑+3H2O,
故答案为:As2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O.
(2)①加盐酸时,可逆反应AsO43-+2I-+2H+⇌AsO33-+I2+H2O,氢离子的浓度变大,平衡正向移动,A中碘离子发生氧化反应为负极,所以C1为负极,
故答案为:右(正反应); 负;
②加NaOH溶液时平衡逆向移动,该过程中C2棒为负极失电子发生氧化反应,电极反应为AsO33-+2OH--2e-=AsO43-+H2O,
故答案为:AsO33-+2OH--2e-=AsO43-+H2O;
(3)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式As2O3+12HCl+6Zn=6ZnCl2+2AsH3↑+3H2O,
故答案为:As2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O.
看了已知砷(As)元素的原子结构示...的网友还看了以下:
关于x的一元二次方程kx^2+(k+2)x+k/4=0,k取何值时,该方程(你看不懂,我在把题读一 2020-05-13 …
高一数学题怎么解1.若集合A={x|x^2+(a-1)x+b=0}中仅有一元素a,求a+b的值.2 2020-05-14 …
已知关于X的一元二次方程x^2+2(k-1)x+k^2-1=0有两个不相等的实数根已知关于x的一元 2020-05-16 …
已知方程(k²-1)x²+(k+1)x+(k-7)y=k+2(1)当k取什么数时,方程为一元一次方 2020-05-16 …
关于X的一元二次方程(K-1)X^2-2KX+k+2=0有两个实数根1)求k的取值范围2)当k取最 2020-05-20 …
(k^2-4)x^2+(k+2)x+(k-6)y=k+8是关于x、y的一次方程k为何值时该方程为为 2020-05-21 …
已知:(k的平方-4)x的平方+(k+2)x+(k-8)y=k+7(1)当k取何值时,方程为一元一 2020-05-23 …
关于x的一元二次方程x^2-(k+2)x+2k=0求证:1)无论k取何值,方程总有实根.2)若等腰 2020-06-02 …
给出下列五种说法:①函数y=-sin(kπ+x)(k∈Z)是奇函数②函数y=tanx的图像关于点( 2020-07-21 …
(一)已知关于x的方程(k^2-1)x^2+(k+1)x-2=0(1)当k为何值时,此方程为一元一 2020-08-01 …