早教吧作业答案频道 -->化学-->
氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用.(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物
题目详情
氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用.
(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol.
该反应体系未达到平衡时,增大压强对逆反应速率的影响是___(填增大、减少或不变).
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式___
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01mol•L-1 N2H4水溶液的pH等于___
(忽略N2H4的二级电离和H2O的电离).
③已知298K和101KPa条件下,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ,则N2H4(l)的标准燃烧热的热化学方程式___
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸.
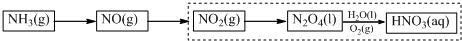
实际操作中,增大N2O4,对此请给出合理解释___.
(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol.
该反应体系未达到平衡时,增大压强对逆反应速率的影响是___(填增大、减少或不变).
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式___
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01mol•L-1 N2H4水溶液的pH等于___
(忽略N2H4的二级电离和H2O的电离).
③已知298K和101KPa条件下,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ,则N2H4(l)的标准燃烧热的热化学方程式___
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸.
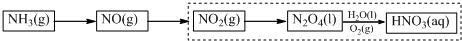
实际操作中,增大N2O4,对此请给出合理解释___.
▼优质解答
答案和解析
(1)对于有气体参加的反应,增大压强正逆反应速率都加快,所以增大压强逆反应速率加快,故答案为:增大;
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O⇌N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=
=
=1.0×10-6,所以c(OH-)=10-4mol/L,则c(H+)=10-10mol/L,则溶液的pH=10;
故答案为:10;
③32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(3)2N2O4+2H2O+O2=4HNO3,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O⇌N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=
| c(N2H5+)×c(OH-) |
| c(N2H4) |
| c2(OH-) |
| 0.01 |
故答案为:10;
③32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(3)2N2O4+2H2O+O2=4HNO3,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
看了 氨气及其相关产品是基本化工原...的网友还看了以下:
室温下,向20.00mL0.8mol•L-1一元酸HA溶液中滴入0.8mol•L-1的NaOH溶液 2020-05-14 …
把一定质量的镁、铝混合物投入到一定体积1mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入1m 2020-05-16 …
铜与1mol/L的硝酸反应,如果NO3-浓度下降0.2mol/L,则溶液中c(H+)同时下降(溶液 2020-05-16 …
关于液化石油气、二氧化碳、氩气体积换算!P1V1=P2V2已知液化石油气密度:液态580kg/m3 2020-05-23 …
1.某10%NaOH溶液,加热蒸发掉100g水后得到80MIL20%的溶液,求该NaOH溶液的物质 2020-07-13 …
已知25℃时,CH3COONH4溶液呈中性.Ⅰ.将0.1mol•L-1的CH3COOH溶液与0.1 2020-07-25 …
已知25℃时,CH3COONH4溶液呈中性.Ⅰ.将0.1mol•L-1的CH3COOH溶液与0.1 2020-07-25 …
0.1mol·L-1的某二元弱酸(H2X)溶液和0.1mol·L-1NaOH溶液等体积混合物(忽略 2020-07-25 …
对弧段L的积分求在弧段L上的积分?被积函数为x^2+y^2,其中L为x^2+y^2+z^2=1与x 2020-08-02 …
实验室中有两瓶溶液:一瓶是0.1mol•L-1的NH3•H2O溶液,另一瓶是由0.2mol•L-1的 2021-02-01 …