早教吧作业答案频道 -->化学-->
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.(1)二氧化碳合成甲醇是碳减排的新方向,已知:①2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g
题目详情
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
(1)二氧化碳合成甲醇是碳减排的新方向,已知:
①2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-677kJ•mol-1
以CO2和H2为原料合成甲醇的热化学方程式为___,
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)___K(B)(填“>”、“<”或“=”).
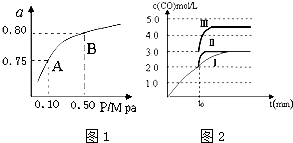
(3)判断反应③△H___0;△S___0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)___v(逆) (填“>”“=”或“<”)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g)⇌H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是___当曲线Ⅰ变为曲线Ⅲ时,改变的条件是___.利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式___.
(4)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液.
常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
以下离子浓度关系的判断正确的是___
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(HSO3-)+2c(SO32-).
(1)二氧化碳合成甲醇是碳减排的新方向,已知:
①2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-677kJ•mol-1
以CO2和H2为原料合成甲醇的热化学方程式为___,
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)⇌CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)⇌H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)⇌CH3OH(g)+H2O (g) | K3 | ||

(3)判断反应③△H___0;△S___0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)___v(逆) (填“>”“=”或“<”)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g)⇌H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是___当曲线Ⅰ变为曲线Ⅲ时,改变的条件是___.利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式___.
(4)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液.
常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(HSO3-)+2c(SO32-).
▼优质解答
答案和解析
(1)①2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
②CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H=-677kJ•mol-1;依据盖斯定律①×
-②得到CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ•mol-1;
故答案为:CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ•mol-1;
(2)依据平衡常数随温度变化,不随压强变化分析,图象中平衡状态由A变到B时,压强改变,温度不变,所以平衡常数不变,故答案为:=;
(3)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.5×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,Q=
=0.93<K=2.5,反应正向进行,V正>V逆;
故答案为:<;<;>;
图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件不好为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
故答案为:加入催化剂;将容器的体积快速压缩至2L;
该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(4)A.NaHSO3溶液呈酸性,则c(H+)>c(OH-),故A错误;
B.Na2SO3溶液因为亚硫酸根水解生成亚硫酸氢根和氢氧根而呈碱性,亚硫酸氢根还水解生成亚硫酸和氢氧根,所以c(OH-)>c(HSO3-),故B错误;
C.溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故C正确;
D.当n(SO32-):n(HSO3-)=1:1时,溶液不成中性,所以c(Na+)不等于c(HSO3-)+2c(SO32-),故D错误;
故选:C.
②CH3OH(g)+
| 3 |
| 2 |
| 3 |
| 2 |
故答案为:CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ•mol-1;
(2)依据平衡常数随温度变化,不随压强变化分析,图象中平衡状态由A变到B时,压强改变,温度不变,所以平衡常数不变,故答案为:=;
(3)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.5×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,Q=
| 5×5 |
| 3 3×1 |
故答案为:<;<;>;
图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件不好为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
故答案为:加入催化剂;将容器的体积快速压缩至2L;
该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(4)A.NaHSO3溶液呈酸性,则c(H+)>c(OH-),故A错误;
B.Na2SO3溶液因为亚硫酸根水解生成亚硫酸氢根和氢氧根而呈碱性,亚硫酸氢根还水解生成亚硫酸和氢氧根,所以c(OH-)>c(HSO3-),故B错误;
C.溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故C正确;
D.当n(SO32-):n(HSO3-)=1:1时,溶液不成中性,所以c(Na+)不等于c(HSO3-)+2c(SO32-),故D错误;
故选:C.
看了 研究碳氧化物的利用对促进低碳...的网友还看了以下:
已知集合A={x/x=3n+1,n∈Z}B={x/x=3n+2,n∈Z}M={x/x=6n+3,n 2020-04-05 …
已知集合A={x/x=3n+1,n∈Z}B={x/x=3n+2,n∈Z}M={x/x=6n+3,n 2020-04-05 …
集合A={x/x=3n+1,n∈Z}B={x/x=3n+2,n∈Z}M={x/x=6n+3,n∈Z 2020-04-05 …
请问T=2×pi×w=2×pi×sqrt(m/k)中w^2=k/m的k和m代表的物理量含义是什么? 2020-05-13 …
将大于整数m且紧靠m的k个素数存入xx所指的数组中.什么叫“紧靠M”?将大于M的素数怎么怎么样那岂 2020-05-13 …
已知双曲线C:,设过点A(-3,0)的直线l的方向向量=(1,k),(1)当直线l与双曲线C的一条 2020-05-15 …
程序test.c的功能是:将大于整数m且紧靠m的k个素数存入数组XX。请考生编写函数num(intm 2020-05-23 …
下列程序的功能是:将大于整数m且紧靠m的k个素数存入数组xx中。请编写函数num(int m, in 2020-05-23 …
下列程序的功能是:将大于整数m且紧靠m的k个素数存入数组xx。请编写函数num(int m,int 2020-05-23 …
若方程组kx−y=14x+my=2有无数组解,则k与m的值分别为()A.k=1,m=1B.k=2, 2020-06-06 …