早教吧作业答案频道 -->化学-->
利用氨气脱硝(除NO)是大气污染防治研究的热点,脱硝过程中涉及的反应为:主反应:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)副反应:①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/m
题目详情
利用氨气脱硝(除NO)是大气污染防治研究的热点,脱硝过程中涉及的反应为:
主反应:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/mol
②4NH3(g)+4O2(g)⇌2N2O(g)+6H2O(g)△H=-1104.9kJ/mol
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1269.0kJ/mol
回答下列问题:
(1)主反应的△H为___
(2)若NH3的初始物质的量为m mol,达到平衡后生成水蒸气的物质的量为n mol,则NH3总平衡转化率为___(写出表达式)
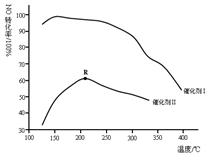
(3)如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:
①选用催化剂I的优势有___(写出一点)
②R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由___.
(4)常温下,在通入氧气的条件下用0.1mol/L的NaOH溶液吸收NO也可实现脱硝(产物主要为NaNO3 和NaNO2),已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数为5.1×10-4),则:
①
=___mol/L
②反应后溶液中NO3-的浓度约为___mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L的硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀___【Ksp(AgNO2)=2×10-8】
主反应:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/mol
②4NH3(g)+4O2(g)⇌2N2O(g)+6H2O(g)△H=-1104.9kJ/mol
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1269.0kJ/mol
回答下列问题:

(1)主反应的△H为___
(2)若NH3的初始物质的量为m mol,达到平衡后生成水蒸气的物质的量为n mol,则NH3总平衡转化率为___(写出表达式)
(3)如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:
①选用催化剂I的优势有___(写出一点)
②R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由___.
(4)常温下,在通入氧气的条件下用0.1mol/L的NaOH溶液吸收NO也可实现脱硝(产物主要为NaNO3 和NaNO2),已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数为5.1×10-4),则:
①
c(N
| ||
| c(HNO2) |
②反应后溶液中NO3-的浓度约为___mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L的硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀___【Ksp(AgNO2)=2×10-8】
▼优质解答
答案和解析
(1)①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/mol
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1269.0kJ/mol,③×2-①得4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g),故主反应的△H=(-1269.0kJ/mol)×2-(-905.5kJ/mol)=-1632.5kJ/mol,
故答案为:-1632.5kJ/mol;
(2)消耗的n(NH3)=
n(H2O)=
n,故NH3总平衡转化率=
×100%=
×100%,
故答案为:
×100%;
(3)①选用催化剂I的优势有:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源,
故答案为:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源;
②观察图象不难发现,低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率,
故答案为:低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率,
(4)①HNO2⇌H++NO2-,则Ka=
,故
=
×c(OH-)=
×10-2=5.1×106,
故答案为:5.1×106;
②根据电荷守恒式:c(H+)+c(Na+)=c(NO3-)+c(NO2-)+c(OH-),可知c(NO3-)=c(H+)+c(Na+)-c(NO2-)-c(OH-)=10-12mol/L+0.1mol/L-5.6
×10-2mol/L-10-2mol/L≈0.1mol/L-5.6×10-2mol/L-10-2mol/L=0.034mol/L,
故答案为:0.034;
③滴入硝酸银溶液后:
c(NO2-)≈1.0×10-6mol/L,c(Ag+)=
≈1.0×10-3mol/L,Qc=c(NO2-)×c(Ag+)≈1.0×10-6×1.0×10-3=1.0×10-9<2×10-8,故不能生成沉淀,
故答案为:不能.
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1269.0kJ/mol,③×2-①得4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g),故主反应的△H=(-1269.0kJ/mol)×2-(-905.5kJ/mol)=-1632.5kJ/mol,
故答案为:-1632.5kJ/mol;
(2)消耗的n(NH3)=
| 2 |
| 3 |
| 2 |
| 3 |
| n反 |
| n原 |
| ||
| m |
故答案为:
| ||
| m |
(3)①选用催化剂I的优势有:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源,
故答案为:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源;
②观察图象不难发现,低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率,
故答案为:低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率,
(4)①HNO2⇌H++NO2-,则Ka=
| c(H+)c(NO2-) |
| c(HNO2) |
c(N
| ||
| c(HNO2) |
| Ka |
| c(H+) |
| 5.1×10-4 |
| 10-12 |
故答案为:5.1×106;
②根据电荷守恒式:c(H+)+c(Na+)=c(NO3-)+c(NO2-)+c(OH-),可知c(NO3-)=c(H+)+c(Na+)-c(NO2-)-c(OH-)=10-12mol/L+0.1mol/L-5.6
×10-2mol/L-10-2mol/L≈0.1mol/L-5.6×10-2mol/L-10-2mol/L=0.034mol/L,
故答案为:0.034;
③滴入硝酸银溶液后:
c(NO2-)≈1.0×10-6mol/L,c(Ag+)=
| 0.1mol/L×0.00005L |
| 0.00505L |
故答案为:不能.
看了 利用氨气脱硝(除NO)是大气...的网友还看了以下:
设f(x)=(x-a)^n*g(x),g(x)在x=a临域内有(n-1)阶连续的到函数,证明:f( 2020-04-27 …
一个mRNA分子有m个碱基,其中G+C有n个;由该mRNA合成的蛋白质有两条肽链.则其模板DNA分 2020-05-20 …
设an=1+1/2+1/3+.1/n,是否存在关于n的正式g(n),使得等式a1+a2+a3+.a 2020-06-12 …
F=1/n(G+G动)怎么推导 2020-06-17 …
已知f(n)=-n,φ(n)=,g(n)=n-,n∈N+,则[]A.f(n)<g(n)<φ(n)B 2020-07-13 …
正整数可以分为两个互不相交的正整数子集:{f(1),f(2),f(3)...f(n)...};{g 2020-07-20 …
一个有关大O(阶)的问题求两个单调递增函数f(n)和g(n)(n为自然数),f(n)≠O(g(n) 2020-07-31 …
已知一个边长为a的等边三角形,现将其边长n(n为大于2的整数)等分,并以相邻等分点为顶点向外作小等 2020-08-01 …
一个mRNA分子有m个碱基,其中G+C有n个;由该mRNA合成的蛋白质有两条肽链.则其模板DNA分子 2020-12-14 …
描述Description一个有趣的圆环套圆环函数被定义如下:G(n)=n-G(G(n-1))(n是 2021-02-04 …