早教吧作业答案频道 -->化学-->
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:①配制0.1mol•L-1的HCl溶液和0.1mol•L-1的NaOH溶液各100mL;
题目详情
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
①配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液各100mL;
②取一粒(药片质量均相同)0.2g的此药片,磨碎后放入烧杯中并加入20.0mL蒸馏水;
③以酚酞为指示剂,用0.1 mol•L-1的NaOH溶液滴定,用去V mL达到滴定终点;
④向烧杯中加入25mL 0.1 mol•L-1的HCl溶液.
(1)请写出正确的实验操作顺序(用序号表示):___.
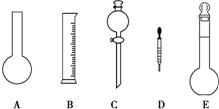
(2)在下图所示的仪器中配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液肯定不需要的是(填序号)___,配制上述溶液还需要的玻璃仪器是(填仪器的名称)___.
(3)配制上述溶液应选用的容量瓶规格是___mL.
(4)写出步骤④中发生的有关反应的离子方程式:___.
(5)在进行步骤③时,判断到达滴定终点时的标志是___.
(6)每粒该胃药中含碳酸钙的质量是___.
①配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液各100mL;
②取一粒(药片质量均相同)0.2g的此药片,磨碎后放入烧杯中并加入20.0mL蒸馏水;
③以酚酞为指示剂,用0.1 mol•L-1的NaOH溶液滴定,用去V mL达到滴定终点;
④向烧杯中加入25mL 0.1 mol•L-1的HCl溶液.

(1)请写出正确的实验操作顺序(用序号表示):___.
(2)在下图所示的仪器中配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液肯定不需要的是(填序号)___,配制上述溶液还需要的玻璃仪器是(填仪器的名称)___.
(3)配制上述溶液应选用的容量瓶规格是___mL.
(4)写出步骤④中发生的有关反应的离子方程式:___.
(5)在进行步骤③时,判断到达滴定终点时的标志是___.
(6)每粒该胃药中含碳酸钙的质量是___.
▼优质解答
答案和解析
(1)用中和滴定法胃药中碳酸钙的含量,先把药片磨碎溶于水,配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液,加过量的盐酸溶解碳酸钙,再用氢氧化钠滴定剩余的盐酸,则实验操作顺序为②①④③,
故答案为:②①④③;
(2)配制溶液的主要操作为:称量或量取用到天平或量筒、在烧杯中溶解用到烧饼和玻璃棒、转移到容量瓶用到容量瓶和玻璃棒、定容用到胶头滴管,所以没有用到的仪器是烧瓶和分液漏斗,即AC;除了图中所给的仪器还需要烧杯和玻璃棒;
故答案为:AC;烧杯、玻璃棒;
(3)要配制100ml盐酸和氢氧化钠溶液,所以选用100ml的容量瓶;
故答案为:100;
(4)步骤④中为盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,其反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(5)以酚酞作指示剂,用氢氧化钠滴定盐酸,溶液由无色变为浅红色,则滴入最后一滴NaOH溶液时,使溶液由无色变为浅红色,且半分钟内不褪色即是滴定终点;
故答案为:滴入最后一滴NaOH溶液时,使溶液由无色变为浅红色,且半分钟内不褪色;
(6)与氢氧化钠反应的盐酸为n(HCl)=n(NaOH)=0.1 mol•L-1×10-3VL=10-4Vmol;
与碳酸钙反应的盐酸为n′(HCl)=0.1 mol•L-1×0.025L-10-4Vmol=(0.0025-10-4V)mol,
已知碳酸钙与盐酸的反应为:CaCO3+2H+═Ca2++CO2↑+H2O,则n(CaCO3)=
×(0.0025-10-4V)mol,
则每粒该胃药中含碳酸钙的质量是
×(0.0025-10-4V)mol×100g/mol=(0.125-0.005V)g;
故答案为:(0.125-0.005V)g.
故答案为:②①④③;
(2)配制溶液的主要操作为:称量或量取用到天平或量筒、在烧杯中溶解用到烧饼和玻璃棒、转移到容量瓶用到容量瓶和玻璃棒、定容用到胶头滴管,所以没有用到的仪器是烧瓶和分液漏斗,即AC;除了图中所给的仪器还需要烧杯和玻璃棒;
故答案为:AC;烧杯、玻璃棒;
(3)要配制100ml盐酸和氢氧化钠溶液,所以选用100ml的容量瓶;
故答案为:100;
(4)步骤④中为盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,其反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(5)以酚酞作指示剂,用氢氧化钠滴定盐酸,溶液由无色变为浅红色,则滴入最后一滴NaOH溶液时,使溶液由无色变为浅红色,且半分钟内不褪色即是滴定终点;
故答案为:滴入最后一滴NaOH溶液时,使溶液由无色变为浅红色,且半分钟内不褪色;
(6)与氢氧化钠反应的盐酸为n(HCl)=n(NaOH)=0.1 mol•L-1×10-3VL=10-4Vmol;
与碳酸钙反应的盐酸为n′(HCl)=0.1 mol•L-1×0.025L-10-4Vmol=(0.0025-10-4V)mol,
已知碳酸钙与盐酸的反应为:CaCO3+2H+═Ca2++CO2↑+H2O,则n(CaCO3)=
| 1 |
| 2 |
则每粒该胃药中含碳酸钙的质量是
| 1 |
| 2 |
故答案为:(0.125-0.005V)g.
看了 碳酸钙可以降低胃酸的浓度而被...的网友还看了以下:
计算行列式:a b 0 ...0 0 0 a b ...0 0 ............0 0 0 2020-05-16 …
探究匀变速直线运动实验中,使用打点计时器得到一条只带,其中0,1,2,3,4,5.为所选的计数点, 2020-06-03 …
5.对反应A+B==AB来说,常温下按以下情况进行反应:①20mL溶液中含A、B各0.01mol② 2020-06-12 …
下面各算式中,计算结果大于0.83的是()A、0.83×lB、0.83×0.1C、0.83×1.0 2020-07-27 …
某混凝土工程,所用配合比为C:S:G=1:1.98:3.90,W/C=0.64.已知混凝土拌合物的 2020-07-30 …
据统计,甲、乙两人投篮的命中率分别为0.5、0.4,若甲、乙两人各投一次,则有人投中的概率是()A 2020-08-02 …
某校对文明班的评选设计了a,b,c,d,e五个方面的多元评价指标,并通过经验公式来计算各班的综合得 2020-08-02 …
某校对文明班的评选设计了a,b,c,d,e五个方面的多元评价指标,并通过经验公式样S=ab+cd+ 2020-08-02 …
a的第十次根为多少?a的0.1次方为多少?(当a=4,它们的各自等于多少?)4的0.7次方怎么计算? 2020-11-24 …
1、选择(1)下列各式可以用乘法分配律进行简算的算式是().A:1.25×5.6×0.8B:0.84 2020-12-09 …