早教吧作业答案频道 -->化学-->
菱铁矿(主要成分是FeCO3)是炼铁的原料.已知FeCO3为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间被氧化为Fe(OH)3.I.(1)甲同学取一定量碳酸亚铁固体于烧杯中,
题目详情
菱铁矿(主要成分是FeCO3)是炼铁的原料.已知FeCO3为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间被氧化为Fe(OH)3.
I.(1)甲同学取一定量碳酸亚铁固体于烧杯中,加入足量水,将烧杯放置在天平左盘上,向右盘放入砝码至天平平衡.放置较长时间后(不考虑水分蒸发),观察到天平的指针会___(填“偏左”、“偏右”、“不发生偏转”);放置过程中还可观察到的实验现象为___.
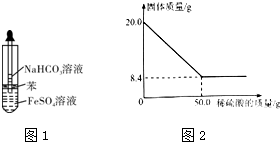
II.乙同学设计图1所示的装置制备FeCO3.(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).滴加NaHCO3溶液后观察到试管中出现白色沉淀,同时有大量无色气体生成.
(2)产生的气体是___ (填分子式).
(3)丙同学对白色沉淀的成分提出异议,并做出如下假设,请补充完成假设3:
假设1:白色沉淀是FeCO3;
假设2:白色沉淀是Fe(OH)2;
假设3:白色沉淀是___.
(4)若假设1成立,写出有关反应的化学方程式:___.
(5)若假设2成立,说明用经煮沸后冷却的蒸馏水配制FeSO4和NaHCO3溶液的目的是___.
请设计一个实验方案验证假设2成立,写出实验步骤、预期现象和结论,实验所需仪器和药品自选.
___.
III.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图2所示.(假设菱铁矿中杂质不参加反应,且难溶于水.)
(6)菱铁矿中FeCO3的质量分数为___
(7)若将稀硫酸改成1mol L-1HNO3,则该反应的离子方程式为___.将反应逸出的气体与一定量的O2混合循环通入反应液中,目的是___.
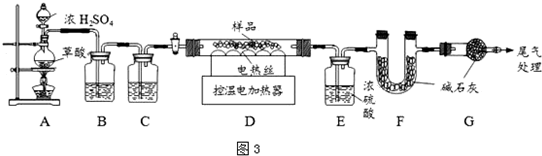
IV.某铁锈成分为Fe2O3•xH2O和FeCO3.为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用图3装置进行实验.
【查阅资料】
①Fe2O3•xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2.
②温度高于500℃时铁的氧化物才能被CO还原.
(8)装配好实验装置后,首先要___.
(9)装置A中的反应为:H2C2O4 (草酸)
CO↑+CO2↑+H2O.通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放___(选填序号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(10)现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g.
则样品中FeCO3的质量m(FeCO3)=___g,x=___.
(11)若缺少G装置,测得的m(FeCO3)___(选填“偏大”、“偏小”、“不变”,下同),x的值会___.
I.(1)甲同学取一定量碳酸亚铁固体于烧杯中,加入足量水,将烧杯放置在天平左盘上,向右盘放入砝码至天平平衡.放置较长时间后(不考虑水分蒸发),观察到天平的指针会___(填“偏左”、“偏右”、“不发生偏转”);放置过程中还可观察到的实验现象为___.
II.乙同学设计图1所示的装置制备FeCO3.(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).滴加NaHCO3溶液后观察到试管中出现白色沉淀,同时有大量无色气体生成.

(2)产生的气体是___ (填分子式).
(3)丙同学对白色沉淀的成分提出异议,并做出如下假设,请补充完成假设3:
假设1:白色沉淀是FeCO3;
假设2:白色沉淀是Fe(OH)2;
假设3:白色沉淀是___.
(4)若假设1成立,写出有关反应的化学方程式:___.
(5)若假设2成立,说明用经煮沸后冷却的蒸馏水配制FeSO4和NaHCO3溶液的目的是___.
请设计一个实验方案验证假设2成立,写出实验步骤、预期现象和结论,实验所需仪器和药品自选.
___.
III.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图2所示.(假设菱铁矿中杂质不参加反应,且难溶于水.)
(6)菱铁矿中FeCO3的质量分数为___
(7)若将稀硫酸改成1mol L-1HNO3,则该反应的离子方程式为___.将反应逸出的气体与一定量的O2混合循环通入反应液中,目的是___.
IV.某铁锈成分为Fe2O3•xH2O和FeCO3.为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用图3装置进行实验.

【查阅资料】
①Fe2O3•xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2.
②温度高于500℃时铁的氧化物才能被CO还原.
(8)装配好实验装置后,首先要___.
(9)装置A中的反应为:H2C2O4 (草酸)
| ||
| △ |
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(10)现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g.
则样品中FeCO3的质量m(FeCO3)=___g,x=___.
(11)若缺少G装置,测得的m(FeCO3)___(选填“偏大”、“偏小”、“不变”,下同),x的值会___.
▼优质解答
答案和解析
(1)在有水与空气下,放置较长时间后,碳酸亚铁会发生反应:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2,从而使左边物质质量变大,则指针或偏右;碳酸亚铁是白色固体、氢氧化铁是红褐色固体,所以颜色也由FeCO3白色变为Fe(OH)3红褐色,
故答案为:偏右;白色固体变成红褐色固体(或产生气泡);
(2)HCO3-和Fe 2+相互促进水解生成Fe(OH)2和CO2,溶液中产生的气体为CO2,
故答案为:CO2;
(3)根据组合可推知假设3为Fe(OH)2和FeCO3,
故答案为:Fe(OH)2和FeCO3;
(4)如果白色沉淀的碳酸亚铁,则硫酸亚铁和碳酸氢钠发生复分解反应,为非氧化还原反应,根据元素守恒及产物的稳定性推知反应方程式为:FeSO4+2NaHCO3=FeCO3↓+H2O+CO2↑+Na2SO4,
故答案为:FeSO4+2NaHCO3=FeCO3↓+H2O+CO2↑+Na2SO4;
(5)煮沸后冷却的蒸馏水配制FeSO4和NaHCO3溶液可以除去水中溶解的氧气,防止生成的Fe(OH)2被迅速氧化;而产物Fe(OH)2验证可通过学生熟悉的颜色变化来设计,其检验方法为向产生白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则说明假设2成立,
故答案为:除去水中溶解的氧气,防止生成的Fe(OH)2被迅速氧化;
向产生白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则说明假设2成立;
(6)碳酸亚铁和稀硫酸反应生成硫酸亚铁和二氧化碳、水,剩余固体为未反应的杂质,则参加反应的m(FeCO3)=(20.0-8.4)g=11.6g,碳酸亚铁的质量分数=
×100%=
×100%=58%,
故答案为:58%;
(7)碳酸亚铁与硝酸发生氧化还原反应,铁的产物为+3价,稀硝酸还原产生为NO,反应方程式为3FeCO3+10H++NO3‾=3Fe3++3CO2↑+NO↑+5H2O,NO与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,为防止NO污染空气,且为提高原料利用率,需循环使用NO,
故答案为:3FeCO3+10H++NO3‾=3Fe3++3CO2↑+NO↑+5H2O;减少环境污染,NO跟H2O、O2反应后又得到硝酸,提高原料利用率;
(8)实验基本操作,装配好实验装置后,首先要检查装置气密性,
故答案为:检查装置气密性;
(9)二氧化碳是酸性氧化物,要除去CO2应该选取溶解性大的碱性溶液,要除去CO2最好选择氢氧化钠溶液,澄清的石灰水浓度低,碱性弱,
故答案为:c;
(10)温度为300℃时,Fe2O3•xH2O失去结晶水(分解温度为110℃),FeCO3分解为FeO和CO2(分解温度为282℃),装置E增重3.6g为水,n(H2O)=
=0.2mol,根据水分子守恒得n(Fe2O3•xH2O)=
mol,装置F增重2.2g为二氧化碳,n(CO2)=
=0.05mol,根据C原子守恒得n(FeCO3)=0.05mol,
0.05mol FeCO3质量为:0.05mol×116mol L-1=5.8g
则Fe2O3•xH2O质量为:25.4g-5.8g=19.6g.
mol×(160+18x)mol L-1=19.6g
x=2,
故答案为:5.8;2;
(11)若缺少G装置,F会吸收部分空气中的水与二氧化碳而增重,使测得的m(FeCO3)偏大,计算所得Fe2O3•xH2O质量偏小,而计算出的x偏大,
故答案为:偏大;偏大.
故答案为:偏右;白色固体变成红褐色固体(或产生气泡);
(2)HCO3-和Fe 2+相互促进水解生成Fe(OH)2和CO2,溶液中产生的气体为CO2,
故答案为:CO2;
(3)根据组合可推知假设3为Fe(OH)2和FeCO3,
故答案为:Fe(OH)2和FeCO3;
(4)如果白色沉淀的碳酸亚铁,则硫酸亚铁和碳酸氢钠发生复分解反应,为非氧化还原反应,根据元素守恒及产物的稳定性推知反应方程式为:FeSO4+2NaHCO3=FeCO3↓+H2O+CO2↑+Na2SO4,
故答案为:FeSO4+2NaHCO3=FeCO3↓+H2O+CO2↑+Na2SO4;
(5)煮沸后冷却的蒸馏水配制FeSO4和NaHCO3溶液可以除去水中溶解的氧气,防止生成的Fe(OH)2被迅速氧化;而产物Fe(OH)2验证可通过学生熟悉的颜色变化来设计,其检验方法为向产生白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则说明假设2成立,
故答案为:除去水中溶解的氧气,防止生成的Fe(OH)2被迅速氧化;
向产生白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则说明假设2成立;
(6)碳酸亚铁和稀硫酸反应生成硫酸亚铁和二氧化碳、水,剩余固体为未反应的杂质,则参加反应的m(FeCO3)=(20.0-8.4)g=11.6g,碳酸亚铁的质量分数=
| 碳酸亚铁质量 |
| 样品质量 |
| 11.6g |
| 20.0g |
故答案为:58%;
(7)碳酸亚铁与硝酸发生氧化还原反应,铁的产物为+3价,稀硝酸还原产生为NO,反应方程式为3FeCO3+10H++NO3‾=3Fe3++3CO2↑+NO↑+5H2O,NO与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,为防止NO污染空气,且为提高原料利用率,需循环使用NO,
故答案为:3FeCO3+10H++NO3‾=3Fe3++3CO2↑+NO↑+5H2O;减少环境污染,NO跟H2O、O2反应后又得到硝酸,提高原料利用率;
(8)实验基本操作,装配好实验装置后,首先要检查装置气密性,
故答案为:检查装置气密性;
(9)二氧化碳是酸性氧化物,要除去CO2应该选取溶解性大的碱性溶液,要除去CO2最好选择氢氧化钠溶液,澄清的石灰水浓度低,碱性弱,
故答案为:c;
(10)温度为300℃时,Fe2O3•xH2O失去结晶水(分解温度为110℃),FeCO3分解为FeO和CO2(分解温度为282℃),装置E增重3.6g为水,n(H2O)=
| 3.6g |
| 18 |
| 0.2 |
| x |
| 2.2g |
| 44g/mol |
0.05mol FeCO3质量为:0.05mol×116mol L-1=5.8g
则Fe2O3•xH2O质量为:25.4g-5.8g=19.6g.
| 0.2 |
| x |
x=2,
故答案为:5.8;2;
(11)若缺少G装置,F会吸收部分空气中的水与二氧化碳而增重,使测得的m(FeCO3)偏大,计算所得Fe2O3•xH2O质量偏小,而计算出的x偏大,
故答案为:偏大;偏大.
看了 菱铁矿(主要成分是FeCO3...的网友还看了以下:
中位线(平行四边形),如图,已知△ABD中,M是AB的中点,C是AB上任意的一点,N、P分别是DC、 2020-03-30 …
下列有关说法正确的是()A.加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量B.检验蔗糖水解 2020-05-13 …
已知中心在原点,其中一个焦点为F(-1,0)的椭圆,经过P(根号2,-根号6/2),椭圆已知中心在 2020-05-16 …
下列关于金属钠的叙述中,正确的是( )A. 为防止钠与水反应时燃烧,可将该反应置于试管中进行,以 2020-05-17 …
中国象棋和国际象棋的知识中国象棋和国际象棋都有车、马、象、卒、帅(王),但中国象棋中的()和()是 2020-06-16 …
在池塘中有一些木桩,已知其中的一根木桩,粗细均匀,露出水面部分的体积为2乘10的负三立方米在池塘中 2020-07-04 …
在网上搜索得知,中国人均拥有森林蓄积量为8.6立方米,北美洲人均森林蓄积量是中国的22.4倍,非洲 2020-07-25 …
某地区为了了解七年级学生交通安全知识的掌握情况,从该地区初中七年级学生中随机抽取部分学生进行安全知 2020-07-29 …
10~18岁的孩子们,请帮个忙哦!爸爸妈妈也可以帮助孩子参与一下哦,请问你知道中国数字科技馆吗?通过 2020-11-28 …
下列与“纸上得来终觉浅,绝知此事要躬行”蕴含哲理相同的是()A.读书破万卷,下笔如有神B.欲知山中事 2020-12-04 …