早教吧作业答案频道 -->化学-->
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.已知:N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1则①N2H4(l)+O2(g)═
题目详情
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
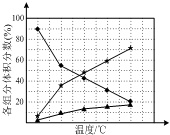
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
 (1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
 24
24
2224-1
222-1
24222-1
2224
24
2424
24
23222322222

已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
 (1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
 24
242224-1
222-1
24222-1
2224
24
2424
24
23222322222

▼优质解答
答案和解析
(1)①a、N22(g)+2H22(g)═N22H44(l);△H=+50.6kJ•mol-1-1
b、2H22(g)+O22(g)═2H22O(l);△H=-571.6kJ•mol-1-1
依据盖斯定律b-a得到N22H44(l)+O22(g)═N22(g)+2H22O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N22(g)+2H22(g)═N22H44(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,
故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨气,可以得到N22H44的稀溶液,该反应的化学方程式为:NaClO+2NH33═N22H44+NaCl+H22O,
故答案为:NaClO+2NH33═N22H44+NaCl+H22O;
(2)使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N22H44
N2+4NH3,
故答案为:3N2H4
N2+4NH3;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
:
=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
△
催化剂 催化剂 催化剂 催化剂△ △ △N22+4NH33,
故答案为:3N22H44
N2+4NH3;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
:
=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
△
催化剂 催化剂 催化剂 催化剂△ △ △N22+4NH33;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
:
=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
43×0.977 14 43×0.977 43×0.977 43×0.97714 14 14:
=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
43×0.023 1 43×0.023 43×0.023 43×0.0231 1 1=3:1,所以该氢化物是N33H,N33H分解生成N22,H22;故分解方程为2HN33⇌3N22+H22,故答案为:2HN33⇌3N22+H22;
故答案为:2HN33═3N22+H22;
(4)设NO物质的量为xmol,NO22为ymol,根据化学方程式6NO+4NH33=5N22+6H22O;6NO22+8NH33=7N22+12H22O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
5 6 5 5 56 6 6x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
7 6 7 7 76 6 6y=15.6
解得:x:y=9:1,
故答案为:9:1.
b、2H22(g)+O22(g)═2H22O(l);△H=-571.6kJ•mol-1-1
依据盖斯定律b-a得到N22H44(l)+O22(g)═N22(g)+2H22O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N22(g)+2H22(g)═N22H44(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,
故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨气,可以得到N22H44的稀溶液,该反应的化学方程式为:NaClO+2NH33═N22H44+NaCl+H22O,
故答案为:NaClO+2NH33═N22H44+NaCl+H22O;
(2)使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N22H44
| ||
| △ |
故答案为:3N2H4
| ||
| △ |
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
| 43×0.977 |
| 14 |
| 43×0.023 |
| 1 |
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| ||
| △ |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.故答案为:3N22H44
| ||
| △ |
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
| 43×0.977 |
| 14 |
| 43×0.023 |
| 1 |
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| ||
| △ |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
| 43×0.977 |
| 14 |
| 43×0.023 |
| 1 |
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| 43×0.977 |
| 14 |
| 43×0.023 |
| 1 |
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| 43×0.023 |
| 1 |
故答案为:2HN33═3N22+H22;
(4)设NO物质的量为xmol,NO22为ymol,根据化学方程式6NO+4NH33=5N22+6H22O;6NO22+8NH33=7N22+12H22O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
看了 (1)联氨(N2H4)是一种...的网友还看了以下:
下列反应不属于氮的固定反应是()A.N2+3Mg点燃.Mg3N2B.N2+3H2高温、高压催化剂2 2020-05-14 …
一道初三的化学题(不懂,请详解)点燃H2,O2,N2的混合体气体,完全反应后生成18克水,则剩余气 2020-05-16 …
H2、O2和N2的混合气体20克,点燃,完全反应后生成18克水,则剩余的气体中不可能是()A.H2 2020-07-12 …
对比以下几个反应式:Cl+Cl=Cl2△H=-247kJ•mol-1;O+O═O2△H=-493k 2020-07-19 …
点燃H2、O2、N2的混合气体20g,完全反应后生成18gH2O,则剩余的气体不可能是A.H2、O 2020-07-20 …
高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)=2NO(g).试通过计算说 2020-10-31 …
将1LH2、O2,N2、Cl2的混合气体在密闭容器里点火,生成1g溶液,则剩下的气体可能是()A.H 2020-11-02 …
(2010•鸡西模拟)点燃H2,O2,N2的混合体气体20克,完全反应后生成18克水,则剩余气体不可 2020-11-11 …
将空气缓慢通过图中a~d装置时,依次除去的气体分别是A.O2、N2、H2O、CO2B.CO2、H2O 2021-01-05 …
将10gH2、O2、N2的混合气体点燃,充分反应生成9gH2O,则该气体不可能是()A.N2和H2B 2021-01-13 …