早教吧作业答案频道 -->化学-->
H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.(1)若利用甲实验,可通过观察现象,
题目详情
H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.
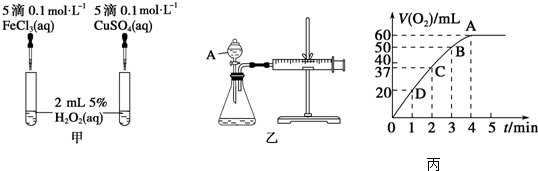
(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).223+2+3+2+22

324322
22222
-12-1-1

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).223+2+3+2+22

324322
22222
-12-1-1
▼优质解答
答案和解析
(1)该反应中产生气体,可根据生成气泡的快慢判断,氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
2H2O+O2↑,A仪器名称是分液漏斗;根据v=△c/△t知,还需要测定产生40mL气体所需的时间,
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H2O2
2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,A仪器名称是分液漏斗;根据v=△c/△t知,还需要测定产生40mL气体所需的时间,
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H22O22
2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H22O22完全反应放出60 mL O22,H22O22的分解反应为2H22O22
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,则n(H22O22)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.06L 22.4L/mol 0.06L 0.06L 0.06L22.4L/mol 22.4L/mol 22.4L/mol×2≈0.00536 mol,c(H22O22)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.00536mol 0.05L 0.00536mol 0.00536mol 0.00536mol0.05L 0.05L 0.05L≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H22SO44=ZnSO44+H22↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.002mol 0.04L×10s 0.002mol 0.002mol 0.002mol0.04L×10s 0.04L×10s 0.04L×10s=0.005mol•L-1-1•s-1-1,
故答案为:0.005.
| ||
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H2O2
| ||
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H22O22
| ||
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H22SO44=ZnSO44+H22↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
看了 H2O2不稳定、易分解,Fe...的网友还看了以下:
实验室常用浓硫酸和乙醇混合加热制取乙烯。(1)实验室制乙烯的化学方程式为。(2)实验室用浓硫酸和乙 2020-04-08 …
探究生长素类似物促进插条生根的最适浓度实验设计1确定什么样的浓度梯度(参照生长素的作用与浓度的关系 2020-05-12 …
某地人口的负增长率为0.2%,实际表示一定需要解释23日之前哦!(⊙o⊙) 2020-06-04 …
图为相关实验所得结果,请分析并回答问题:(1)图1为使用花生子叶进行脂肪鉴定实验,该实验使用的染色 2020-06-10 …
下表是小明测一滑轮组机械效率时收集的有关数据.(1)将表格中的数据补充完整,该数据为.(2)实验时 2020-06-11 …
如图是模仿英国科学家普罗斯特勒做过的一个实验示意图(注:玻璃罩是密闭的)(1)该实验中,甲和乙是作 2020-06-26 …
1.钢铁腐蚀时,铁为什么是失去2个电子生成Fe2+,而不是失去3个电子成为Fe3+?2.实验室配置 2020-06-30 …
从土壤中分离能降解酚类化合物对羟基苯甲酸的微生物实验过程如图所示,请据图回答下列问题。(1)本实验 2020-07-20 …
在探究馒头在口腔中的消化过程时,作如下处理:(1)该实验中,如果只探究牙齿的咀嚼和舌的搅拌对馒头的 2020-07-29 …
实验室配制质量分数为10%的NaCl溶液,如图1是某同学的实验操作过程:(1)用图1中的序号表示配 2020-08-03 …