早教吧作业答案频道 -->化学-->
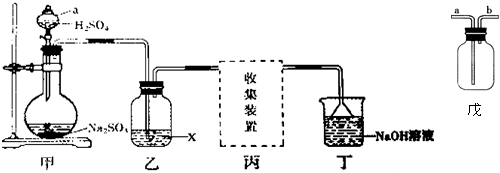
实验室用Na2SO3和70%硫酸溶液反应制取SO2,某研究性学习小组设计如下实验,制取并探究SO2的性质.(制取SO2反应原理为:Na2SO3+2H2SO4═Na2SO4+SO2↑+H2O)探究实验(1)甲装置中a仪器的名称
题目详情
实验室用Na2SO3和70%硫酸溶液反应制取SO2,某研究性学习小组设计如下实验,制取并探究SO2的性质.
(制取SO2反应原理为:Na2SO3+2H2SO4═Na2SO4+SO2↑+H2O)
【探究实验】(1)甲装置中a仪器的名称是___.
(2)实验中若生成若生成标准状况下1.12LSO2,则需要Na2SO3___g参加反应.
(已知:Na2SO3的摩尔质量为126g•mol-1)
(3)①若X是品红溶液,气体通过乙装置,观察到的现象是___;
②若X是酸性KMnO4溶液,气体通过乙装置,观察到溶液褪色,说明SO2具有___.
A.酸性 B.还原性 C.漂白性
(4)丁装置中NaOH溶液的作用是吸收多余的SO2,请将其中反应的化学方程式补充完整:
SO2+NaOH═___+H2O
【实验讨论】(5)若X是浓硫酸,用于干燥SO2气体,在丙处选用如图戊所示的收集装置,
A、B两位同学的连接方式为:
A同学:SO2气体从a导管通入集气瓶中.
B同学:SO2气体从b导管通入集气瓶中.
正确的收集装置是___(填“A”或“B”)同学的连接方式.
(已知:同等条件下SO2的密度大于空气)
【知识应用】
(6)向盛有水的烧杯中通入SO2,所得溶液的pH___(填“>”或“=”或“<”)7.SO2是形成酸雨的主要物质,请你提出一种减少SO2对空气污染的可行措施:___.

(制取SO2反应原理为:Na2SO3+2H2SO4═Na2SO4+SO2↑+H2O)
【探究实验】(1)甲装置中a仪器的名称是___.
(2)实验中若生成若生成标准状况下1.12LSO2,则需要Na2SO3___g参加反应.
(已知:Na2SO3的摩尔质量为126g•mol-1)
(3)①若X是品红溶液,气体通过乙装置,观察到的现象是___;
②若X是酸性KMnO4溶液,气体通过乙装置,观察到溶液褪色,说明SO2具有___.
A.酸性 B.还原性 C.漂白性
(4)丁装置中NaOH溶液的作用是吸收多余的SO2,请将其中反应的化学方程式补充完整:
SO2+NaOH═___+H2O
【实验讨论】(5)若X是浓硫酸,用于干燥SO2气体,在丙处选用如图戊所示的收集装置,
A、B两位同学的连接方式为:
A同学:SO2气体从a导管通入集气瓶中.
B同学:SO2气体从b导管通入集气瓶中.
正确的收集装置是___(填“A”或“B”)同学的连接方式.
(已知:同等条件下SO2的密度大于空气)
【知识应用】
(6)向盛有水的烧杯中通入SO2,所得溶液的pH___(填“>”或“=”或“<”)7.SO2是形成酸雨的主要物质,请你提出一种减少SO2对空气污染的可行措施:___.
▼优质解答
答案和解析
(1)根据图示可知,装置甲中仪器a的名称为分液漏斗,故答案为:分液漏斗;
(2)标准状况下1.12LSO2的物质的量为:
=0.05mol,根据反应Na2SO3+2H2SO4═Na2SO4+SO2↑+H2O可知,生成0.05mol二氧化硫需要消耗0.05mol亚硫酸钠,其质量为:126g/mol×0.05mol=6.3g,
故答案为:6.3;
(3)①若X为品红溶液,二氧化硫具有漂白性,生成的二氧化硫气体能够使品红溶液褪色,
故答案为:品红溶液褪色;
②若X是酸性KMnO4溶液,酸性高锰酸钾溶液具有强氧化性,当气体通过乙装置时酸性高锰酸钾溶液褪色,说明SO2被氧化,二氧化硫表现出了还原性,
故答案为:B;
(4)二氧化硫有毒,为酸性氧化物,多余的二氧化硫需要用碱液吸收,二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O,
故答案为:1;2;1;1;Na2SO3;
(5)若X是浓硫酸,用于干燥SO2气体,在丙处选用如图戊所示的收集装置,由于二氧化硫的密度大于空气,则进入集气瓶的导管应该长,即:SO2气体从a导管通入集气瓶中,故选A,
故答案为:A;
(6)二氧化硫为酸性氧化物,向盛有水的烧杯中通入SO2,二氧化硫与水反应生成亚硫酸,亚硫酸部分电离出氢离子,则所得溶液的pH<7;
SO2是形成酸雨的主要物质,需要采取措施减少SO2对空气污染,方法如:①减少化石燃料的使用;②对SO2的排放加以控制;③改善能源结构、开发利用清洁能源;④工业上对煤进行脱硫处理;⑤对SO2气体进行处理货回收利用,
故答案为:<;减少化石燃料的使用(或对SO2的排放加以控制,改善能源结构、开发利用清洁能源,工业上对煤进行脱硫处理,对SO2气体进行处理货回收利用).
(2)标准状况下1.12LSO2的物质的量为:
| 1.12L |
| 22.4L/mol |
故答案为:6.3;
(3)①若X为品红溶液,二氧化硫具有漂白性,生成的二氧化硫气体能够使品红溶液褪色,
故答案为:品红溶液褪色;
②若X是酸性KMnO4溶液,酸性高锰酸钾溶液具有强氧化性,当气体通过乙装置时酸性高锰酸钾溶液褪色,说明SO2被氧化,二氧化硫表现出了还原性,
故答案为:B;
(4)二氧化硫有毒,为酸性氧化物,多余的二氧化硫需要用碱液吸收,二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O,
故答案为:1;2;1;1;Na2SO3;
(5)若X是浓硫酸,用于干燥SO2气体,在丙处选用如图戊所示的收集装置,由于二氧化硫的密度大于空气,则进入集气瓶的导管应该长,即:SO2气体从a导管通入集气瓶中,故选A,
故答案为:A;
(6)二氧化硫为酸性氧化物,向盛有水的烧杯中通入SO2,二氧化硫与水反应生成亚硫酸,亚硫酸部分电离出氢离子,则所得溶液的pH<7;
SO2是形成酸雨的主要物质,需要采取措施减少SO2对空气污染,方法如:①减少化石燃料的使用;②对SO2的排放加以控制;③改善能源结构、开发利用清洁能源;④工业上对煤进行脱硫处理;⑤对SO2气体进行处理货回收利用,
故答案为:<;减少化石燃料的使用(或对SO2的排放加以控制,改善能源结构、开发利用清洁能源,工业上对煤进行脱硫处理,对SO2气体进行处理货回收利用).
看了实验室用Na2SO3和70%硫...的网友还看了以下:
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能,写出相应的离子方程 2020-04-11 …
化学是从微观层次上认识物质.(1)某微观示意图如图所示:①该反应的基本反应类型为.②该反应生成物的 2020-05-13 …
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:(1)氨气可以构成燃料电池,其电池反应 2020-05-15 …
酸碱盐反应反时为什么必须是溶液 2020-06-05 …
某同学在做过氧化氢溶液分解产生氧气的反应中,为探究氧化铜是否能催化过氧化氢溶液的分解,特做如下探究 2020-07-21 …
Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O═BO 2020-07-21 …
某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素.该探究性学习小组用相同质量的锌和相同浓度 2020-11-01 …
某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4 2020-11-28 …
硫醇-烯具有反应过程相对简单、反应过程可控等优点,成为近年来有机合成的研究热点之一,如反应①(1)化 2020-12-05 …
实验室用Na2SO3和70%硫酸溶液反应制取SO2,某研究性学习小组设计如下实验,制取并探究SO2的 2021-02-01 …