早教吧作业答案频道 -->化学-->
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研
题目详情
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
(1)反应2SO2(g)+O2(g)⇌2SO3(g)是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是___
A.加入V2O5作催化剂,.B.通过量空气C.高温D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=___;用O2的浓度变化表示从O-2min内该反应的平均速率v=___;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率___50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是___
A.v(SO2)=2v(O2)
B.容器内压强保持不变.
B.v逆(SO3)=v正(SO2)
D.容器内物质的密度保持不变.
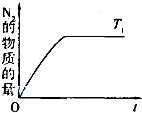
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染,请写出CH4与NO反应的化学方程式:___;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应).

(1)反应2SO2(g)+O2(g)⇌2SO3(g)是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是___
A.加入V2O5作催化剂,.B.通过量空气C.高温D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=___;用O2的浓度变化表示从O-2min内该反应的平均速率v=___;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率___50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是___
A.v(SO2)=2v(O2)
B.容器内压强保持不变.
B.v逆(SO3)=v正(SO2)
D.容器内物质的密度保持不变.
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染,请写出CH4与NO反应的化学方程式:___;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应).
▼优质解答
答案和解析
(1)A、加入催化剂,催化剂不影响化学平衡,二氧化硫的转化率不变,故错误;
B、通入过量的空气,平衡向着正向移动,二氧化硫的转化率增大,故正确;
C、升高温度,平衡向着逆向移动,二氧化硫的转化率减小,故错误;
D、增大压强,增大压强,平衡向着正向移动,二氧化硫的转化率增大,故正确;
故选:BD;
(2)一定条件下,2SO2(g)+O2(g)⇌2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,列出化学平衡的三段式计算:
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=
=5.76;
用O2的浓度变化表示从O-2min内该反应的平均速率v=
=0.125mol/(L•min)
若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%,
故答案为:5.76;0.125mol/(L•min);<;
(3)A.v(SO2)=2v(O2),只要反应发生,速率之比就符合这样的关系,故错误;
B.容器内压强保持不变,说明达平衡状态,故正确.
C.v逆(SO3)=v正(SO2),正逆反应速率相等,故正确;
D.容器内物质的密度始终保持不变,故错误;
故选:BC;
(4)CH4与NO反应的化学方程式为CH4+4NO═2N2+CO2+2H2O;升高温度平衡逆向移动,N2的物质的量减小,达平衡的时间缩短,所以图形为: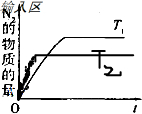 ,故答案为:CH4+4NO═2N2+CO2+2H2O;
,故答案为:CH4+4NO═2N2+CO2+2H2O; ;
;
B、通入过量的空气,平衡向着正向移动,二氧化硫的转化率增大,故正确;
C、升高温度,平衡向着逆向移动,二氧化硫的转化率减小,故错误;
D、增大压强,增大压强,平衡向着正向移动,二氧化硫的转化率增大,故正确;
故选:BD;
(2)一定条件下,2SO2(g)+O2(g)⇌2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,列出化学平衡的三段式计算:
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=
| 0.62 |
| 0.52×0.25 |
用O2的浓度变化表示从O-2min内该反应的平均速率v=
| 0.25 |
| 2 |
若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%,
故答案为:5.76;0.125mol/(L•min);<;
(3)A.v(SO2)=2v(O2),只要反应发生,速率之比就符合这样的关系,故错误;
B.容器内压强保持不变,说明达平衡状态,故正确.
C.v逆(SO3)=v正(SO2),正逆反应速率相等,故正确;
D.容器内物质的密度始终保持不变,故错误;
故选:BC;
(4)CH4与NO反应的化学方程式为CH4+4NO═2N2+CO2+2H2O;升高温度平衡逆向移动,N2的物质的量减小,达平衡的时间缩短,所以图形为:
 ,故答案为:CH4+4NO═2N2+CO2+2H2O;
,故答案为:CH4+4NO═2N2+CO2+2H2O; ;
;
看了导致空气污染的主要原因来自于化...的网友还看了以下:
类比法是化学研究物质的重要方法之一.草酸(化学式为:H2C2O4)的化学性质与碳酸相似.已知碳酸易 2020-05-02 …
“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中.所谓“纳米材料”是指研 2020-05-16 …
英语翻译智能建筑材料的研制是一个迅速发展的新领域,它吸引建筑设计及建筑施工领域等的众多学科研究者的 2020-05-21 …
自然界中,生物与环境相互作用,适应者生存下来并不断的延续和发展着.有关生物进化的研究总是与遗传学分 2020-06-08 …
硼的化学丰富多彩,也是材料化学研究的热点之一。⑴最近美国RiceUniversity的教授Bori 2020-07-05 …
自然界中,生物与环境相互作用,适应者生存下来并不断的延续和发展着,有关生物进化的研究总是与遗传学分不 2020-11-14 …
下列不属于化学研究范畴的是()A.使废旧塑料变成燃料B.检测城市的大气状况,研究将汽车排放有害尾气转 2020-11-20 …
化学研究物质的变化,能研究和创造自然界不存在的物质.下列选项属于新型研究项目的是①新型的半导体②电阻 2020-12-04 …
“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中.所谓“纳米材料”是指研究 2020-12-25 …
自然界中,生物与环境相互作用,适应者生存下来并不断的延续和发展着.有关生物进化的研究总是与遗传学分不 2021-01-02 …