早教吧作业答案频道 -->化学-->
如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.Ⅰ.工作一段时间后,断开K,此时C电极质量减少3.2g.(1)甲中负极的电解反应式为(2)乙溶液此时离子浓度
题目详情
如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.
Ⅰ.工作一段时间后,断开K,此时C电极质量减少3.2g.
(1)甲中负极的电解反应式为___
(2)乙溶液此时离子浓度由大到小的顺序是___
Ⅱ.连接K,继续电解一段时间,当A、B两极上产生的气体体积相同时
(3)乙中A极析出的气体在标准状况下的体积为___
(4)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是___离子的变化;此时要使丙装置中金属阳离子恰好完全沉淀,需要___mL 5.0moL/L NaOH溶液.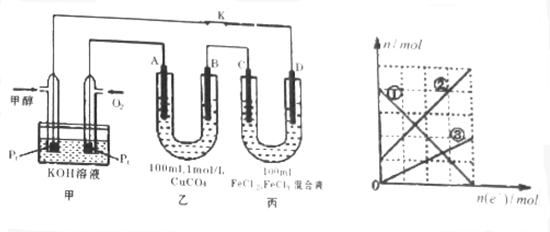
Ⅰ.工作一段时间后,断开K,此时C电极质量减少3.2g.
(1)甲中负极的电解反应式为___
(2)乙溶液此时离子浓度由大到小的顺序是___
Ⅱ.连接K,继续电解一段时间,当A、B两极上产生的气体体积相同时
(3)乙中A极析出的气体在标准状况下的体积为___
(4)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是___离子的变化;此时要使丙装置中金属阳离子恰好完全沉淀,需要___mL 5.0moL/L NaOH溶液.

▼优质解答
答案和解析
Ⅰ(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)100mL1mol/L的硫酸铜溶液中含有铜离子0.1mo,硫酸根离子0.1mol,当电解硫酸铜溶液时,阴极反应式为:Cu2++2e-=Cu,阳极反应式为:4OH--4e-=2H2O+O2↑,C极有3.2gCu即0.05mol溶解,转移电子0.1mol,A极反应掉氢氧根离子0.1mol,生成氢离子0.1mol,B极反应掉铜离子0.05mol,剩余铜离子0.05mol,硫酸根离子物质的量没有变化,溶液中还存在水的电离平衡,所以离子浓度大小顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-);
Ⅱ(3)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4x x
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L;
故答案为:2.24L;
(4)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(3)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为1.4mol5mol/L=0.28L=280ml,
故答案为:Fe2+;280.
(2)100mL1mol/L的硫酸铜溶液中含有铜离子0.1mo,硫酸根离子0.1mol,当电解硫酸铜溶液时,阴极反应式为:Cu2++2e-=Cu,阳极反应式为:4OH--4e-=2H2O+O2↑,C极有3.2gCu即0.05mol溶解,转移电子0.1mol,A极反应掉氢氧根离子0.1mol,生成氢离子0.1mol,B极反应掉铜离子0.05mol,剩余铜离子0.05mol,硫酸根离子物质的量没有变化,溶液中还存在水的电离平衡,所以离子浓度大小顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-);
Ⅱ(3)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4x x
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L;
故答案为:2.24L;
(4)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(3)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为1.4mol5mol/L=0.28L=280ml,
故答案为:Fe2+;280.
看了如图是甲醇燃料电池工作的示意图...的网友还看了以下:
同一温度平衡:①PCl5(g)?PCl3(g)+Cl2(g)△H>0 K=1mol/L②CO(g) 2020-05-17 …
证明题!如果a是f′′′(x)的一个k重跟,证明g(x)=(x-a)/2[f′(x)+f′(a)] 2020-06-12 …
反应Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H1平衡常数为K1Fe(s)+H2O(g) 2020-07-18 …
三元一次方程组a*x+b*y+c*z+d=0,e*x+f*y+g*z+h=0,i*x+j*y+k* 2020-08-03 …
无穷级数的求解t取1到正无穷1、∑1/(1+k)^t=1/k;2、∑(1+g)^t/(1+k)^t, 2020-10-31 …
图论中:设G=(n,m),且G中每个顶点的度数不是k,就是k+1,则G中度为k的顶点的个数是多少 2020-11-17 …
G是初二学生,与K同座。G经常抄K的作业,有时候不打招呼就把K没做完的作业抢去抄写。这样,K自己的学 2020-11-27 …
接触法制硫酸的核心反应是2SO2(g)+O2(g)⇌2SO3(g)△H<0.(1)该反应的平衡常数K 2020-12-31 …
接触法制硫酸的核心反应是2SO2(g)+O2(g)⇌2SO3(g)△H<0.(1)该反应的平衡常数K 2020-12-31 …
接触法制硫酸的核心反应是2SO2(g)+O2(g)⇌2SO3(g)△H<0.(1)该反应的平衡常数K 2020-12-31 …