早教吧作业答案频道 -->化学-->
CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义.利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为:①CH4(g)═C(s)+2H2(g)△H
题目详情
CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义.利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为:
①CH4(g)═C(s)+2H2(g)△H=75.0kJ•mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=41.0kJ•mol-1
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ•mol-1
(1)反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的△H=___.
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图1.
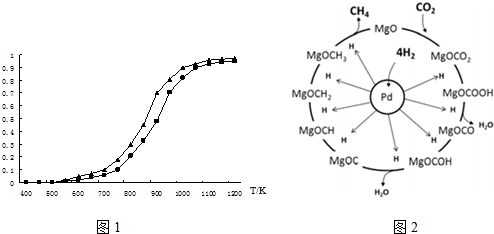
①同温度下CO2的平衡转化率___(填“大于”或“小于”)于CH4的平衡转化率,其原因是___.
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是___.
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图2所示,该反应的化学方程式为___,反应过程中碳元素的化合价为-2价的中间体是___.
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4+Na2CO3═CaCO3+Na2SO4,则达到平衡后,溶液中
=___.[用Ksp(CaSO4)和Ksp(CaCO3)表示].
①CH4(g)═C(s)+2H2(g)△H=75.0kJ•mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=41.0kJ•mol-1
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ•mol-1
(1)反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的△H=___.
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图1.

①同温度下CO2的平衡转化率___(填“大于”或“小于”)于CH4的平衡转化率,其原因是___.
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是___.
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图2所示,该反应的化学方程式为___,反应过程中碳元素的化合价为-2价的中间体是___.
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4+Na2CO3═CaCO3+Na2SO4,则达到平衡后,溶液中
| c(CO32-) |
| c(SO42-) |
▼优质解答
答案和解析
(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,故答案为:+247kJ/mol;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,故答案为:该反应△H>0,△S>0,高温时△G=△H-T△S<0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2=CH4+2H2O;反应过程中碳元素的化合价为-2价的中间体是MgOCH2,故答案为:CO2+4H2=CH4+2H2O;MgOCH2;
(4)达到平衡后,Ksp(CaCO3)=c(Ca2+)•c(CO32-),Ksp(CaSO4)=c(Ca2+)•c(SO42-),在
分子和分母同乘以钙离子的浓度,所以溶液中
=
,
故答案为:
.
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,故答案为:+247kJ/mol;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,故答案为:该反应△H>0,△S>0,高温时△G=△H-T△S<0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2=CH4+2H2O;反应过程中碳元素的化合价为-2价的中间体是MgOCH2,故答案为:CO2+4H2=CH4+2H2O;MgOCH2;
(4)达到平衡后,Ksp(CaCO3)=c(Ca2+)•c(CO32-),Ksp(CaSO4)=c(Ca2+)•c(SO42-),在
| c(CO32-) |
| c(SO42-) |
| c(CO32-) |
| c(SO42-) |
| Ksp(CaCO3) |
| Ksp(CaSO4) |
故答案为:
| Ksp(CaCO3) |
| Ksp(CaSO4) |
看了CO2的回收利用对减少温室气体...的网友还看了以下:
下列关于合同履行的表述正确的是()A.在合同履行中,双方当事人的权利和义务是合同履行的核心B.履行 2020-06-09 …
我国在土地资源利用和保护方面的基本国策是()A.因地制宜,合理布局B.合理开发,使之永续利用C.占 2020-06-27 …
谁会这道题:下列有关合成氨工业的下列有关合成氨工业的途述,可用勒夏特列原理来解释的是[]A.使用铁 2020-07-08 …
我国关于土地的基本国策正确的是()A.十分珍惜、合理利用土地B.十分珍惜、合理利用土地和切实保护耕地 2020-11-21 …
关于我国土地资源的基本国策是()A.加大投入,努力提高土地生产效率B.创造有利于合理利用和保护土地的 2020-11-21 …
国土规划是指[]A.全国综合农业区划B.一个国家经济发展的总体部署C.对全国土地资源进行合理开发,利 2020-12-17 …
我国耕地人均量少、分别不均,回答12-13题:我国的土地基本国策是()A.占多少,垦多少B.合理开发 2020-12-22 …
读图,回答20-21题我国在土地资源利用和保护方面的基本国策是()A.因地制宜,合理布局B.合理开发 2020-12-22 …
不能用化学平衡移动原理来说明的事实是()A.合成氨在高压下进行是有利的B.温度过高对合成氨不利C.使 2021-01-22 …
下列事实不能用勒沙特列原理来解释的是()A.加压有利于SO2与O2反应生成SO3B.500℃左右比常 2021-02-01 …