早教吧作业答案频道 -->化学-->
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小
题目详情
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-
]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设 计如下方案制备上述两种产品:
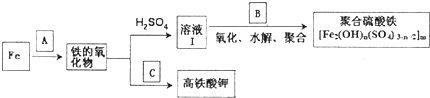
请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出Fe与H20(g)反应的化学方程式的电子式:___.
(2)若B为NaCl03与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为CD):___.
(3)若C为KKO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸鉀的化学方程式并配平:
___Fe2O3+___KNO3+___KOH-______+___KNO2+______
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H202,调节pH<3,加热除去过量H202;加入过量KI充分反应后,再用O.1OOOmol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
①写出滴定选用的指示剂___,滴定终点观察到的现象___:
②溶液Ⅰ中轶元素的总含量为___g•L-1.若滴定前溶液中H202没有除尽,所测定的铁元素的含量将会___ (填“偏高”“偏低”“不变”).
(5)设计实验方案,检验溶液I中的Fe2+和Fe3+___.
| n |
| 2 |

请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出Fe与H20(g)反应的化学方程式的电子式:___.
(2)若B为NaCl03与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为CD):___.
(3)若C为KKO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸鉀的化学方程式并配平:
___Fe2O3+___KNO3+___KOH-______+___KNO2+______
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H202,调节pH<3,加热除去过量H202;加入过量KI充分反应后,再用O.1OOOmol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
①写出滴定选用的指示剂___,滴定终点观察到的现象___:
②溶液Ⅰ中轶元素的总含量为___g•L-1.若滴定前溶液中H202没有除尽,所测定的铁元素的含量将会___ (填“偏高”“偏低”“不变”).
(5)设计实验方案,检验溶液I中的Fe2+和Fe3+___.
▼优质解答
答案和解析
(1)Fe与水蒸气在高温下反应的化学方程式为:3Fe+4H2O(g)
Fe304+4H2,
故答案为:3Fe+4H2O(g)
Fe304+4H2;
(2)根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据化合价升降相等配平,配平后的离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O,
故答案为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
(3)KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则亚铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O,
故答案为:1、3、4、2、K2FeO4、3、2、H2O;
(4)①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点,
故答案为:淀粉;溶液由蓝色变无色且保持半分钟不变色;
②由2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-可得:Fe3+~S2O32-,则n(Fe3+)=n(S2O32-)=0.1000mol/L×0.02L=0.002mol,铁元素总含量为:
=5.6g/L;
H2O2也能氧化I-生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高,
故答案为:5.6;偏高;
(5)检验溶液I中的Fe2+和Fe3+的方法为:取溶液Ⅰ少量于试管中,加入硫酸酸化,再加入高锰酸钾溶液,溶液颜色从深紫色变成黄色或变浅,则含有Fe2+(或取溶液Ⅰ少量于试管中,加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+);另取溶液Ⅰ少量于试管中,滴加硫氰化钾溶液,如果变为红色,证明含有铁离子
故答案为:取溶液Ⅰ少量于试管中,加入硫酸酸化,再加入高锰酸钾溶液,溶液颜色从深紫色变成黄色或变浅,则含有Fe2+(或取溶液Ⅰ少量于试管中,加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+);另取溶液Ⅰ少量于试管中,滴加硫氰化钾溶液,如果变为红色,证明含有铁离子.
| ||
故答案为:3Fe+4H2O(g)
| ||
(2)根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据化合价升降相等配平,配平后的离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O,
故答案为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
(3)KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则亚铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O,
故答案为:1、3、4、2、K2FeO4、3、2、H2O;
(4)①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点,
故答案为:淀粉;溶液由蓝色变无色且保持半分钟不变色;
②由2Fe3++2I-═2Fe2++I2、I2+2S2O32-═2I-+S4O62-可得:Fe3+~S2O32-,则n(Fe3+)=n(S2O32-)=0.1000mol/L×0.02L=0.002mol,铁元素总含量为:
| 56g/mol×0.002mol |
| 0.02L |
H2O2也能氧化I-生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高,
故答案为:5.6;偏高;
(5)检验溶液I中的Fe2+和Fe3+的方法为:取溶液Ⅰ少量于试管中,加入硫酸酸化,再加入高锰酸钾溶液,溶液颜色从深紫色变成黄色或变浅,则含有Fe2+(或取溶液Ⅰ少量于试管中,加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+);另取溶液Ⅰ少量于试管中,滴加硫氰化钾溶液,如果变为红色,证明含有铁离子
故答案为:取溶液Ⅰ少量于试管中,加入硫酸酸化,再加入高锰酸钾溶液,溶液颜色从深紫色变成黄色或变浅,则含有Fe2+(或取溶液Ⅰ少量于试管中,加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+);另取溶液Ⅰ少量于试管中,滴加硫氰化钾溶液,如果变为红色,证明含有铁离子.
看了铁及其化合物有重要用途,如聚合...的网友还看了以下:
REALFLOW水滴滴入水面溅起水花的效果,要求水面在水滴进入之前是绝对静止的.水花要用慢镜表现.细 2020-03-30 …
H3O-,NO3-,Fe2+,Na+是不是不能共存?是因为H3O-,N03-,相当于H+,N03- 2020-05-17 …
298K时,在Fe3+,Fe2+的混合溶液中加入NaOH时,有Fe(OH)3,Fe(OH)2沉淀生 2020-05-21 …
离心泵的效率等于()。A.机械效率×容积效率+水力效率;B.机械效率+容积效率×水力效率;C.机械效 2020-05-31 …
碘单质和Fe2+氧化性谁大I负离子可还原Fe3+到Fe2+,由反应方程式可看出氧化性Fe3+>I2 2020-06-22 …
什么"虹吸"效应?物理里面关于水的效应古罗马的一坐高架水渠,水渠内部平坦,水流在里面却可以只按一个 2020-06-23 …
工业上用电解法生产烧碱的主要原料是饱和食盐水,它是将粗盐溶解在水中,通过一定的分离和提纯制成的.由 2020-06-29 …
夏天用同样多的0℃的水和0℃的冰来冷却饮料,结果是()A.用冰的效果好,因为冰的温度低B.用水的效 2020-07-14 …
现有下列十种物质:①液态HNO3②O2③固态K2O④SO3⑤铜⑥熔融态的NaOH⑦分散质粒子直径约 2020-07-29 …
下列物质的转化在给定条件下能实现的是()A.NaO2/△Na2O2HI(aq)NaIB.Fe2O3H 2020-10-30 …