早教吧作业答案频道 -->化学-->
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅
题目详情
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
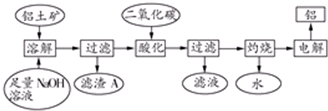
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:___.
(2)滤渣A的主要成分___;硅铝酸盐沉淀写成氧化物的形式是___.
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
(4)若该工厂用mkg铝土矿共制得n kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为___.
(5)若将铝溶解,下列试剂中最好选用___(填编号).
A.浓硫酸B. 稀硫酸C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是___,配位数为____.

已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:___.
(2)滤渣A的主要成分___;硅铝酸盐沉淀写成氧化物的形式是___.
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
(4)若该工厂用mkg铝土矿共制得n kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为___.
(5)若将铝溶解,下列试剂中最好选用___(填编号).
A.浓硫酸B. 稀硫酸C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是___,配位数为____.
▼优质解答
答案和解析
铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝,
(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水,反应的离子方程式为:,
故答案为:2OH-+Al2O3═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O;
(2)由于氢氧化钠是足量的,所以Al2O3和SiO2充分反应,生成Na2SiO3和NaAlO2,而铝土矿的主要成分是Al2O3,SiO2少量,那么生成的Na2SiO3少,NaAlO2多,
发生反应2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH后,滤渣有之前不反应的Fe2O3和生成的Na2Al2Si2O8,滤液中有NaOH、余下大量的NaAlO2;
氧化物的形式为:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,则改写成氧化物的形式为:Na2O•Al2O3•2SiO2,
故答案为:Fe2O3;Na2Al2Si2O8、Na2O•Al2O3•2SiO2;
(3)从第2小题的分析可知滤液中的NaAlO2要转化成Al(OH)3不能用盐酸,盐酸是强酸,强酸过量后Al(OH)3会溶解,
故答案为:Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率;
(4)已知铝nkg,可算出铝的物质的量,n(Al)=
=
mol,根据原子守恒可得:2Al~Al2O3,则三氧化二铝的物质的量:n(Al2O3)=
n(Al),
n(Al2O3)=
mol,所以Al2O3的质量为:m=n(Al2O3)•M(Al2O3)=
mol×102 g•mol-1 =
g,所以Al2O3的质量分数为:
×100%=
%或
%,
故答案为:
%或
%.
(5)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B;
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目,这里的配位原子是氟原子,有6个,
故答案为:[AlF6]3-;6.
(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水,反应的离子方程式为:,
故答案为:2OH-+Al2O3═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O;
(2)由于氢氧化钠是足量的,所以Al2O3和SiO2充分反应,生成Na2SiO3和NaAlO2,而铝土矿的主要成分是Al2O3,SiO2少量,那么生成的Na2SiO3少,NaAlO2多,
发生反应2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH后,滤渣有之前不反应的Fe2O3和生成的Na2Al2Si2O8,滤液中有NaOH、余下大量的NaAlO2;
氧化物的形式为:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,则改写成氧化物的形式为:Na2O•Al2O3•2SiO2,
故答案为:Fe2O3;Na2Al2Si2O8、Na2O•Al2O3•2SiO2;
(3)从第2小题的分析可知滤液中的NaAlO2要转化成Al(OH)3不能用盐酸,盐酸是强酸,强酸过量后Al(OH)3会溶解,
故答案为:Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率;
(4)已知铝nkg,可算出铝的物质的量,n(Al)=
| 1000ng |
| 27g/mol |
| 1000n |
| 27 |
| 1 |
| 2 |
n(Al2O3)=
| 500n |
| 27 |
| 500n |
| 27 |
| 51000n |
| 27 |
| ||
| 1000mg |
| 5100n |
| 27m |
| 1700n |
| 9m |
故答案为:
| 5100n |
| 27m |
| 1700n |
| 9m |
(5)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B;
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目,这里的配位原子是氟原子,有6个,
故答案为:[AlF6]3-;6.
看了铝是一种重要的金属,在生产、生...的网友还看了以下:
金鱼缸里红金鱼比黑金鱼的条数少25条,正好比黑金鱼少15.红金鱼和黑金鱼各有多少条? 2020-06-20 …
九个箱子,每个箱子里都装着一样大小的金条.其中有一箱金条是假的,真金条每个一斤,假金条每个九两,比 2020-07-10 …
古代四个兄弟共有黄金450.如果老大的黄金增加20两,老二的黄金减少20两,老三的黄金翻一番,老四 2020-07-19 …
已知集合A={a1,a2,a3,a4},B={0,1,2,3},f是从A到B的映射.(1)若B中每 2020-07-30 …
设f(x)存在二阶导数,下列结论正确的是A若f(x)只有两个零点,则f'(x)必定只有一个零点B若 2020-07-30 …
f(x)=(x-1)^2的导数f'(x)=多少?y=(3x-6)^2的导数y'|x=1=多少?64 2020-07-31 …
有关映射设M={a,b,c},N={1,2,3}则从M到N的映射个数为多少个?从M到N满足f(a) 2020-08-02 …
紧急求助!!!南开大学关于专业硕士研究生的说明1、专业硕士全部自费(包括推荐免试生),不参评学业奖学 2020-11-13 …
设f(X)在(-∞,+∞)上存在二阶导数,且f(0)0,证明f(X)至少一个实根至多两个实根.意思是 2020-12-14 …
上海世博会上,各国展馆纷纷展示本民族文化的独特风采,如丹麦的“小美人鱼”、卢森堡的“金色少女”像…… 2021-01-14 …