早教吧作业答案频道 -->化学-->
乙二胺四乙酸可由乙二胺(H2NCH2CH2NH2)、氰化钠(NaCN)和甲醛水溶液作用制得,能和Fe3+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如下:(1)Fe3+基态核外电子排布式为.(2)与CN
题目详情
乙二胺四乙酸可由乙二胺(H2NCH2CH2NH2)、氰化钠(NaCN)和甲醛水溶液作用制得,能和Fe3+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如下:
(1)Fe3+基态核外电子排布式为___.
(2)与CN-互为等电子体的一种非极性分子为___(填化学式).
(3)乙二胺四乙酸中C原子的轨道杂化类型是___;C、N、O三种元素的电负性由大到小的顺序是___.
(4)乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___.
(5)请在乙二胺四乙酸铁钠结构图中用“箭头”表示出配位键.

(1)Fe3+基态核外电子排布式为___.
(2)与CN-互为等电子体的一种非极性分子为___(填化学式).
(3)乙二胺四乙酸中C原子的轨道杂化类型是___;C、N、O三种元素的电负性由大到小的顺序是___.
(4)乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___.
(5)请在乙二胺四乙酸铁钠结构图中用“箭头”表示出配位键.
▼优质解答
答案和解析
(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为:[Ar]3d5或1s22s22p63s23p63d5,
故答案为:[Ar]3d5或1s22s22p63s23p63d5;
(2)CN-中含有两个原子且价电子数是10,所以与CN-互为等电子体的一种分子的化学式:N2,
故答案为:N2;
(3)乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;同周期自左而右电负性增大,故电负性:O>N>C,
故答案为:sp2、sp3;O>N>C;
(4)分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高,故答案为:乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(5)配位键由含有孤电子对的原子指向含有空轨道的原子,中心原子Fe具有空轨道,N、O原子含有孤电子对,所以该配合物中的配位键为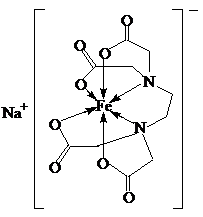 ,
,
故答案为: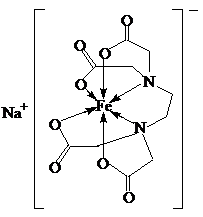 .
.
故答案为:[Ar]3d5或1s22s22p63s23p63d5;
(2)CN-中含有两个原子且价电子数是10,所以与CN-互为等电子体的一种分子的化学式:N2,
故答案为:N2;
(3)乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;同周期自左而右电负性增大,故电负性:O>N>C,
故答案为:sp2、sp3;O>N>C;
(4)分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高,故答案为:乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(5)配位键由含有孤电子对的原子指向含有空轨道的原子,中心原子Fe具有空轨道,N、O原子含有孤电子对,所以该配合物中的配位键为
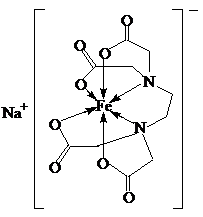 ,
,故答案为:
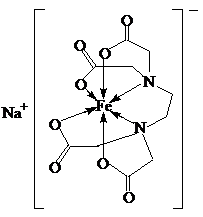 .
.
看了乙二胺四乙酸可由乙二胺(H2N...的网友还看了以下:
将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解 2020-04-07 …
络合物的稳定常数已知k(稳)[Ag(NO3)2+]=1.6*10^7已知25℃时,K稳[Ag(NO 2020-06-14 …
下列有关溶液、乳浊液的描述中正确的是()A.油污溶于汽油得到的混合物属于乳浊液B.可用过滤的方法将 2020-06-14 …
PH复合电极工作原理大体原理知道,变送器测量内外参比电极的电位差,再计算出PH值,内参比电极内不是 2020-06-27 …
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极 2020-07-14 …
用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余的电解质溶液中加入适量的物质不能使溶液恢复到 2020-07-16 …
下列各组物质性质的比较中正确的是()A.CH4、CCl4、C60都是含有极性键的非极性分子B.非金属 2020-12-07 …
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液 2020-12-12 …
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是K 2020-12-12 …
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液 2020-12-12 …