早教吧作业答案频道 -->化学-->
卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在.(1)在元素周期表中,Ca位于第周期,第族.是区元素.(2)分析化学上常用F-作为Fe的掩蔽剂,基态Fe2+核
题目详情
卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在.
(1)在元素周期表中,Ca位于第___周期,第___族.是___区元素.
(2)分析化学上常用F-作为Fe的掩蔽剂,基态Fe2+核外电子排布式为___.
(3)N、O、F、Ca四种元素电负性从大到小的顺序为:___.
(4)HF、HCl、HBr、HI沸点由高到低的顺序为:___,热稳定性由高到低的顺序为:___.
(5)与HF互为等电子体的一种阴离子的电子式为___,1molNH4NO3中含有σ键数目为___.其中阴、阳离子中心原子杂化类型分别为:___.
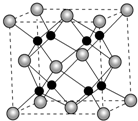
(6)CaF2晶胞结构如图所示,下列关于CaF2的表述正确的是___.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体类型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
e.晶胞中Ca2+的配位数与Ca2+个数比为2:1.

(1)在元素周期表中,Ca位于第___周期,第___族.是___区元素.
(2)分析化学上常用F-作为Fe的掩蔽剂,基态Fe2+核外电子排布式为___.
(3)N、O、F、Ca四种元素电负性从大到小的顺序为:___.
(4)HF、HCl、HBr、HI沸点由高到低的顺序为:___,热稳定性由高到低的顺序为:___.
(5)与HF互为等电子体的一种阴离子的电子式为___,1molNH4NO3中含有σ键数目为___.其中阴、阳离子中心原子杂化类型分别为:___.
(6)CaF2晶胞结构如图所示,下列关于CaF2的表述正确的是___.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体类型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
e.晶胞中Ca2+的配位数与Ca2+个数比为2:1.
▼优质解答
答案和解析
(1)Ca是20号元素,四个电子层,最外层2个电子,所以Ca位于第四周期,第ⅡA族,是s区元素,故答案为:四;ⅡA; s;
(2)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(3)同一周期中,元素的电负性随着原子序数的增大而增大,所以N、O、F、Ca四种元素电负性从大到小的顺序是F>O>N>Ca,故答案为:F>O>N>Ca;
(4)相对分子质量越大,沸点越高,但是由于HF存在氢键,故沸点比HI要高,故沸点顺序为:HF>HI>HBr>HCl,非金属性:F>Cl>Br>I,所以对应氢化物稳定性为:HF>HCl>HBr>HI,故答案为:HF>HI>HBr>HCl; HF>HCl>HBr>HI;
(5)与HF互为等电子体的一种阴离子是氢氧根离子,氢氧根离子的电子式为: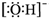 ,1molNH4NO3中含有4mol氮氢σ键和3mol氧氮σ键,所以含有σ键数目为7mol,其中阳离子铵根离子是sp3杂化,阴离子硝酸根离子中的氮是 sp2杂化,故答案为:
,1molNH4NO3中含有4mol氮氢σ键和3mol氧氮σ键,所以含有σ键数目为7mol,其中阳离子铵根离子是sp3杂化,阴离子硝酸根离子中的氮是 sp2杂化,故答案为: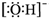 ;7mol(或7×6.02×1023); sp2、sp3;
;7mol(或7×6.02×1023); sp2、sp3;
(6)a.阴阳离子间存在静电引力和静电斥力,Ca2+与F-间存在静电吸引作用,还存在静电斥力,故a错误;
b.离子晶体的熔点与离子所带电荷、离子半径有关,离子半径越小,离子晶体的熔点越高,所以CaF2的熔点高于CaCl2,故b正确;
c.晶体的结构与电荷比、半径比有关,阴阳离子比为2:1的物质,与CaF2晶体的电荷比相同,若半径比相差较大,则晶体构型不相同,故c错误;
d.CaF2中的化学键为离子键,离子化合物在熔融时能发生电离,存在自由移动的离子,能导电,因此CaF2在熔融状态下能导电,故b正确;
e.该晶胞中灰色球个数=8×
+6×
=4,黑色球个数为8,根据其化学式知,灰色球表示钙离子、黑色球表示氟离子,在同一个晶胞中每个面心上的灰色球连接4个黑色球,每个面心上灰色球连接两个晶胞,所以每个钙离子(灰色球)连接8个氟离子(黑色球),所以钙离子配位数是8,所以晶胞中Ca2+的配位数与Ca2+个数比为2:1,故答案为:bde.
(2)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(3)同一周期中,元素的电负性随着原子序数的增大而增大,所以N、O、F、Ca四种元素电负性从大到小的顺序是F>O>N>Ca,故答案为:F>O>N>Ca;
(4)相对分子质量越大,沸点越高,但是由于HF存在氢键,故沸点比HI要高,故沸点顺序为:HF>HI>HBr>HCl,非金属性:F>Cl>Br>I,所以对应氢化物稳定性为:HF>HCl>HBr>HI,故答案为:HF>HI>HBr>HCl; HF>HCl>HBr>HI;
(5)与HF互为等电子体的一种阴离子是氢氧根离子,氢氧根离子的电子式为:
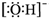 ,1molNH4NO3中含有4mol氮氢σ键和3mol氧氮σ键,所以含有σ键数目为7mol,其中阳离子铵根离子是sp3杂化,阴离子硝酸根离子中的氮是 sp2杂化,故答案为:
,1molNH4NO3中含有4mol氮氢σ键和3mol氧氮σ键,所以含有σ键数目为7mol,其中阳离子铵根离子是sp3杂化,阴离子硝酸根离子中的氮是 sp2杂化,故答案为: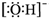 ;7mol(或7×6.02×1023); sp2、sp3;
;7mol(或7×6.02×1023); sp2、sp3;(6)a.阴阳离子间存在静电引力和静电斥力,Ca2+与F-间存在静电吸引作用,还存在静电斥力,故a错误;
b.离子晶体的熔点与离子所带电荷、离子半径有关,离子半径越小,离子晶体的熔点越高,所以CaF2的熔点高于CaCl2,故b正确;
c.晶体的结构与电荷比、半径比有关,阴阳离子比为2:1的物质,与CaF2晶体的电荷比相同,若半径比相差较大,则晶体构型不相同,故c错误;
d.CaF2中的化学键为离子键,离子化合物在熔融时能发生电离,存在自由移动的离子,能导电,因此CaF2在熔融状态下能导电,故b正确;
e.该晶胞中灰色球个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
看了卤族元素中Cl、Br、I在海洋...的网友还看了以下:
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请 2020-04-08 …
有a、b、c、d、e、f、g七种物质.a为HCl,f的元素质量比为7:3.a能与b、f、d反应,c 2020-05-02 …
“F是一个矩阵,只在第i行第j列有一个非零元素,其他元素都是零”怎么翻译成英语?或者这样说“矩阵F 2020-05-13 …
CH4、NH3、H2O和HF均为含10e-的分子.(1)N、O、F三种元素中,与基态C原子的核外未 2020-05-14 …
元素周期表目前有7个周期.第123周期称为短周期,分别含有()()()种元素周期表目前有7个周期. 2020-05-21 …
[化学—物质结构与性质](1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小 2020-07-21 …
hdu2569递推式为什么是这样?设当悬崖的长度为n时,到达彼岸的方法有F[n]种.F[1]=3, 2020-07-21 …
碳、氮、氧、氟都是位于第二周期的重要的非金属元素。请回答下列问题:(1)基态氟原子的核外电子排布式 2020-07-29 …
A、B、C、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元 2020-07-29 …
有含钠元素的两种物质A和B,它们与化合物F的反应分别是A+F→C+D↑;B+F→C+E↑,又知常温下 2020-12-02 …