早教吧作业答案频道 -->化学-->
工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:回答下列问题:(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、.(2)上述反应是否都是氧化还
题目详情
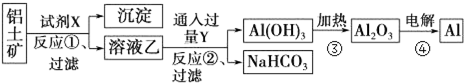
工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、___.
(2)上述反应是否都是氧化还原反应___(填“是”或“否”);写出反应①的化学方程式___.
(3)反应 ①后过滤的沉淀为___,简述确定此物质中金属元素及其价态的操作过程:___.
(4)利用铝制得的镁铝合金用途很广泛,比如用作手机机身,某课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数.
I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金
溶液
称量灼烧产物的质量.
用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是___.
II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:
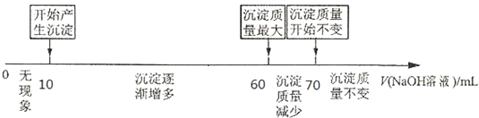
当加入60~70ml氢氧化钠溶液时,请写出发生的离子方程式___.
你判断,根据图数轴中的数据能否求出合金中铝的质量分数?___(选填“能”或“不能”).若能计算,则铝的质量分数是___.

回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、___.
(2)上述反应是否都是氧化还原反应___(填“是”或“否”);写出反应①的化学方程式___.
(3)反应 ①后过滤的沉淀为___,简述确定此物质中金属元素及其价态的操作过程:___.
(4)利用铝制得的镁铝合金用途很广泛,比如用作手机机身,某课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数.
I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金
| 过量盐酸 |
| |
| 过量NaOH溶液 |
| |
| 过滤、洗涤、烧灼、冷却 |
| |
用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是___.
II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:

当加入60~70ml氢氧化钠溶液时,请写出发生的离子方程式___.
你判断,根据图数轴中的数据能否求出合金中铝的质量分数?___(选填“能”或“不能”).若能计算,则铝的质量分数是___.
▼优质解答
答案和解析
铝土矿(主要成分为Al2O3,只含Fe2O3杂质),根据流程图可知,加入试剂X为氢氧化钠溶液,Fe2O3和氢氧化钠不反应而氧化铝能反应,所以得到沉淀为Fe2O3,溶液乙为偏铝酸钠溶液,向偏铝酸钠溶液中通入过量的Y为二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠溶液,过滤得到氢氧化铝的沉淀,再加热分解得到氧化铝,最后电解得到铝单质,
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:漏斗;
(2)上述反应中反应①②③都是非氧化还原反应,反应①为氧化铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:否;Al2O3+2NaOH=2NaAlO2+H2O;
(3)根据上面的分析可知,反应 ①后过滤的沉淀为Fe2O3,要确定氧化铁中金属元素及其价态,可以用酸溶解,再用KSCN溶液检验铁离子的存在,操作过程为取少量沉淀于一支洁净试管,加入适量稀硫酸(或盐酸)使其完全溶解,再滴加少量硫氰化钾(或硫氰化铵),若溶液呈(血)红色,说明它为Fe2O3,
故答案为:Fe2O3;取少量沉淀于一支洁净试管,加入适量稀硫酸(或盐酸)使其完全溶解,再滴加少量硫氰化钾(或硫氰化铵),若溶液呈(血)红色,说明它为Fe2O3;
(4)I.灼烧得到的是氧化镁,所以要计算合金中镁的质量分数,还需要称量合金样品的质量,
故答案为:合金样品的质量;
II.当加入60~70ml氢氧化钠溶液时,沉淀的质量减小,是氢氧化铝与氢氧化钠发生反应生成了偏铝酸钠,反应的离子方程式为Al(OH)3+2OH-=2 AlO2-+H2O,根据数轴可知,溶解氢氧化铝消耗的氢氧化钠溶液是70ml-60ml=10ml,则生成氢氧化铝消耗的氢氧化钠溶液体积应该是30ml,所以生成氢氧化镁消耗的氢氧化钠溶液体积是60ml-10ml-30ml=20ml,则根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓可知Al和Mg的物质的量之比是1:1的,则铝的质量分数是
×100%=52.94%,
故答案为:Al(OH)3+2OH-=2 AlO2-+H2O;能;52.94%.
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:漏斗;
(2)上述反应中反应①②③都是非氧化还原反应,反应①为氧化铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:否;Al2O3+2NaOH=2NaAlO2+H2O;
(3)根据上面的分析可知,反应 ①后过滤的沉淀为Fe2O3,要确定氧化铁中金属元素及其价态,可以用酸溶解,再用KSCN溶液检验铁离子的存在,操作过程为取少量沉淀于一支洁净试管,加入适量稀硫酸(或盐酸)使其完全溶解,再滴加少量硫氰化钾(或硫氰化铵),若溶液呈(血)红色,说明它为Fe2O3,
故答案为:Fe2O3;取少量沉淀于一支洁净试管,加入适量稀硫酸(或盐酸)使其完全溶解,再滴加少量硫氰化钾(或硫氰化铵),若溶液呈(血)红色,说明它为Fe2O3;
(4)I.灼烧得到的是氧化镁,所以要计算合金中镁的质量分数,还需要称量合金样品的质量,
故答案为:合金样品的质量;
II.当加入60~70ml氢氧化钠溶液时,沉淀的质量减小,是氢氧化铝与氢氧化钠发生反应生成了偏铝酸钠,反应的离子方程式为Al(OH)3+2OH-=2 AlO2-+H2O,根据数轴可知,溶解氢氧化铝消耗的氢氧化钠溶液是70ml-60ml=10ml,则生成氢氧化铝消耗的氢氧化钠溶液体积应该是30ml,所以生成氢氧化镁消耗的氢氧化钠溶液体积是60ml-10ml-30ml=20ml,则根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓可知Al和Mg的物质的量之比是1:1的,则铝的质量分数是
| 27 |
| 27+24 |
故答案为:Al(OH)3+2OH-=2 AlO2-+H2O;能;52.94%.
看了工业上用铝土矿(主要成分为Al...的网友还看了以下:
1.PT切圆O于T,CT为直径,D为OC上的一点,支线PD交圆O于B和A,B在线段PD上,若CD= 2020-04-12 …
铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中.铝土矿的主要成分是Al2O3 2020-05-13 …
O、A、B、C为空间四个点,又OA、OB、OC为空间的一个基底,则()A.O、A、B、C四点不共线 2020-05-14 …
求高中人教版英语课本听力我是福建莆田的高中生,欲提高英语成绩,所以要听力,在网上找都是男性朗读,且 2020-05-16 …
《望湖楼醉书》用了几种颜色、几种比喻?苏轼的《望湖楼醉书》:黑云翻墨未遮山……这首诗用了几个颜色, 2020-05-20 …
当x→0时,用o(x)表示比x高阶的无穷小,则下列式子中错误的是()A.x•o(x2)=o(x3) 2020-06-14 …
大气臭氧层的反应是:O+O3=2O2△H,该反应的能量变化如图所示,下列叙述中,正确的是()A.O+ 2020-10-31 …
铝有良好的导电性、良好的延展性、密度小等物理属性.下列有关铝的应用中,分别利用了铝的哪种物理属性:( 2020-11-02 …
当x→0时,用o(x)表示比x高阶的无穷小,则下列式子中错误的是()A.x?o(x2)=o(x3)B 2020-12-05 …
用●表示实心圆,用o表示空心圆,现在有若干实心圆和空心圆按一定规律排列如下●o●●o●●●o●o●● 2020-12-20 …