早教吧作业答案频道 -->化学-->
回答下列问题:(1)SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是.常温下,Na2SO3溶液的pH7,原因是(用
题目详情
回答下列问题:
(1)SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是___.常温下,Na2SO3溶液的pH___7,原因是(用离子方程式表示)___.
(2)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2(g)+
O2(g)⇌SO3(g)△H=-98kJ•mol-1.某温度下该反应的平衡常数K=
.
①该温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正)___ v(逆)(填“<”、“>”或“=”).
②该温度下,向一体积为2L的恒容密闭容器中充入2.0mol SO2和1.0molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为___.
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是___(填字母).
A.保持温度和容器体积不变,充入1.0mol O2
B.降低温度
C.保持温度和容器体积不变,充入1.0mol SO3
D.增大容器体积
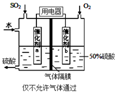
(3)若以如图所示装置,用电化学原理生产硫酸,通入O2电极的电极反应式为___
(4)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为___.

(1)SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是___.常温下,Na2SO3溶液的pH___7,原因是(用离子方程式表示)___.
(2)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2(g)+
| 1 |
| 2 |
| 10 |
| 3 |
①该温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正)___ v(逆)(填“<”、“>”或“=”).
②该温度下,向一体积为2L的恒容密闭容器中充入2.0mol SO2和1.0molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为___.
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是___(填字母).
A.保持温度和容器体积不变,充入1.0mol O2
B.降低温度
C.保持温度和容器体积不变,充入1.0mol SO3
D.增大容器体积
(3)若以如图所示装置,用电化学原理生产硫酸,通入O2电极的电极反应式为___
(4)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为___.
▼优质解答
答案和解析
(1)Na2SO3溶液吸收SO2气体生成NaHSO3,时发生反应的离子方程式为:SO2+SO32-+H2O=2HSO3-;Na2SO3为强碱弱酸盐,SO32-水解使得溶液显碱性,pH>7,且分步水解,水解反应离子方程式为SO32-+H2O⇌HSO3-+OH-;
故答案为:SO2+SO32-+H2O=2HSO3-;>;SO32-+H2O⇌HSO3-+OH-;
(2)①此时浓度商Qc=
=
>K=
,反应向逆反应进行,则v(正)<v(逆),
故答案为:<;
②恒温恒压下,压强之比等于物质的量之比,则平衡后混合气体物质的量为(2+1)mol×
=2.4mol,则:
2SO2(g)+O2(g)⇌2SO3(g)△n
2 1
1.2mol 3mol-2.4mol=0.6mol
则SO2的平衡转化率为
×100%=60%,
故答案为:60%;
③A.保持温度和容器体积不变,充入1.0 mol O2,平衡正向移动,SO2(g)平衡浓度比原来减小,故A正确;
B.保持温度和容器内压强不变,充入1.0 mol SO3,与原平衡为等效平衡,SO2(g)平衡浓度与原来相等,故B错误;
C.降低温度,平衡正向移动,平衡常数增大,容器的容积减小,三氧化硫的浓度增大,由于体系中二氧化硫与氧气的浓度之比为2:1,故二者浓度增大,故SO2(g)平衡浓度比原来增大,故C错误;
D.移动活塞压缩气体,压强增大,平衡正向移动,三氧化硫浓度增大,平衡常数不变,二氧化硫与氧气浓度均增大,故D错误,
故选:A;
(3)用电化学原理生产硫酸,气体隔膜不能使气体通过,右侧通入氧气,发生还原反应,左侧发生氧化反应,SO2电极上SO2失去电子氧化生成硫酸,电极反应式为:SO2失去电子氧化生成硫酸,SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)原溶液为50%硫酸,则溶液中n(H2SO4):n(H2O)=
:
=9:49,
2SO2+O2+2H2O=2H2SO4
9mol 9mol 9mol
故通入SO2和水的质量比为9mol×64g/mol:(9mol+49mol)×18g/mol=16:29,
故答案为:16:29.
故答案为:SO2+SO32-+H2O=2HSO3-;>;SO32-+H2O⇌HSO3-+OH-;
(2)①此时浓度商Qc=
| 0.032 |
| 0.032×0.06 |
| 50 |
| 3 |
| 10 |
| 3 |
故答案为:<;
②恒温恒压下,压强之比等于物质的量之比,则平衡后混合气体物质的量为(2+1)mol×
| 1.6L |
| 2L |
2SO2(g)+O2(g)⇌2SO3(g)△n
2 1
1.2mol 3mol-2.4mol=0.6mol
则SO2的平衡转化率为
| 1.2mol |
| 2mol |
故答案为:60%;
③A.保持温度和容器体积不变,充入1.0 mol O2,平衡正向移动,SO2(g)平衡浓度比原来减小,故A正确;
B.保持温度和容器内压强不变,充入1.0 mol SO3,与原平衡为等效平衡,SO2(g)平衡浓度与原来相等,故B错误;
C.降低温度,平衡正向移动,平衡常数增大,容器的容积减小,三氧化硫的浓度增大,由于体系中二氧化硫与氧气的浓度之比为2:1,故二者浓度增大,故SO2(g)平衡浓度比原来增大,故C错误;
D.移动活塞压缩气体,压强增大,平衡正向移动,三氧化硫浓度增大,平衡常数不变,二氧化硫与氧气浓度均增大,故D错误,
故选:A;
(3)用电化学原理生产硫酸,气体隔膜不能使气体通过,右侧通入氧气,发生还原反应,左侧发生氧化反应,SO2电极上SO2失去电子氧化生成硫酸,电极反应式为:SO2失去电子氧化生成硫酸,SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)原溶液为50%硫酸,则溶液中n(H2SO4):n(H2O)=
| 1 |
| 98 |
| 1 |
| 18 |
2SO2+O2+2H2O=2H2SO4
9mol 9mol 9mol
故通入SO2和水的质量比为9mol×64g/mol:(9mol+49mol)×18g/mol=16:29,
故答案为:16:29.
看了回答下列问题:(1)SO2是造...的网友还看了以下:
(2014•韶关二模)下列过程的离子方程式正确的是()A.用烧碱溶液吸收Cl2:Cl2+2OH-═ 2020-07-10 …
下列过程的离子方程式正确的是A.用烧碱溶液吸收Cl2:Cl2+2OH-=Cl-+ClO-+H2OB 2020-07-15 …
编写一个程序,计算s=a+aa+aaa+.......+aa.....a(如2+22+222+22 2020-07-19 …
在匀速直线运动中,下列关于公式v=s/t的说法中正确的是()A.当时间t一定时,速度v与路程S成正 2020-07-20 …
数学参数方程x=Scos(a)y=Tsin(a)若S=T=r,r为正常数,a为参数,且S=T则方程 2020-08-02 …
四元一次方程组等式变换.在计算机数字图像水印处理中用到的四元一次方程组.已知常数R、G、B、S;未 2020-08-03 …
求教一个微积分建模问题一物体加速度a与路程s的平方成反比,a=22.5/s^2,物体初始速度为0,加 2020-10-30 …
1.在匀速直线运动中,下列关于公式V=S/T的说法正确的是:A速度v与路程s成正比.B速度v与时间t 2020-11-29 …
一个路程问题设线段AB长为S,一点P从点A以初速度a出发向B移动,它的速度等于未行驶过的路程PB,那 2020-12-05 …
已知加速度a(m/s)和时间t(s)求加速度路程s与a和t之间的函数关系已知减速度v(m/s)和原速 2020-12-09 …