早教吧作业答案频道 -->化学-->
(1)恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1),请回答下列问题:①写出能表示硫的燃烧热
题目详情
(1)恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1),请回答下列问题:
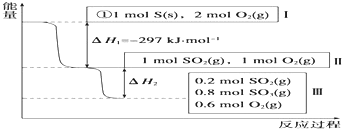
①写出能表示硫的燃烧热的热化学方程式:___.
②在相同条件下,充入1mol SO3和0.5mol 的O2,则达到平衡时SO3的转化率为___;此时该反应___(填“放出”或“吸收”)___KJ的能量.
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=___mol•L-1•min-1.
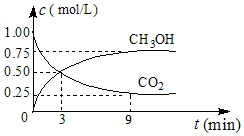
②能说明上述反应达到平衡状态的是___(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)⇌CH3OH(g)的平衡常数.下列说法正确的是___.
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.

①写出能表示硫的燃烧热的热化学方程式:___.
②在相同条件下,充入1mol SO3和0.5mol 的O2,则达到平衡时SO3的转化率为___;此时该反应___(填“放出”或“吸收”)___KJ的能量.
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=___mol•L-1•min-1.

②能说明上述反应达到平衡状态的是___(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)⇌CH3OH(g)的平衡常数.下列说法正确的是___.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
▼优质解答
答案和解析
(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
(2)根据图象所给的信息可知,反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数K=
=
=
,在相同条件下,充入1molSO3和0.5molO2,设反应达到平衡时SO3转化了Xmol,则有:
2SO2(g)+O2(g)⇌2SO3(g)
初始:0 0.5mol/L 1mol/L
变化:Xmol/L 0.5Xmol/L Xmol/L
平衡:Xmol/L (0.5+0.5X)mol/L (1-X)mol/L
根据温度不变,平衡常数K的值不变可知:K=
=
解得:X=0.2mol,故反应达到平衡时SO3的转化率为
×100%=20%;三氧化硫消耗,说明反应从(1)的逆方向开始,故吸热;由热化学方程式2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1可知,2SO3(g)⇌2SO2(g)+O2(g)△H=-196.6kJ•mol-1即1molSO3分解吸收98.3KJ的热量,则0.2molSO3分解吸收的热量Q=98.3KJ×0.2=19.66KJ;
故答案为:20%;吸收;19.66;
(2)①由图象可知,3min-09min内二氧化碳浓度减少了0.25mol/L,则该时间段内氢气的浓度减少3×0.25mol/L=0.75mol/L,则v(H2)=
=0.125mol/L;
故答案为:0.125;
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1时,没有达到平衡状态,故A错误;
B.由于气体的总质量不变,容器的体积不变,则无论是否达到平衡状态,气体的密度都不变,故B错误;
C.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故答案为:D;
(3)A、依据平衡常数随温度变化和平衡移动原理分析判断,随温度升高平衡常数减小,正反应为放热反应,故A正确;
B、由A得正反应为放热反应,△H<0,根据△G=△H-T△S<0自发,△G=△H-T△S>0非自发,又在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
,故B正确;
C、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.1 0.2 0
变化量(mol/L) 0.1×50% 0.1 0.05
平衡量(mol/L) 0.05 0.1 0.05
平衡常数K=
=100,故C正确;
D、升温平衡逆向进行,此条件是催化剂活性最大,不是原料气的转化率高,故D错误;
故选ABC.
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
(2)根据图象所给的信息可知,反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数K=
| c2(SO3) |
| c2(SO2)•c(O2) |
| 0.82 |
| 0.22×0.6 |
| 80 |
| 3 |
2SO2(g)+O2(g)⇌2SO3(g)
初始:0 0.5mol/L 1mol/L
变化:Xmol/L 0.5Xmol/L Xmol/L
平衡:Xmol/L (0.5+0.5X)mol/L (1-X)mol/L
根据温度不变,平衡常数K的值不变可知:K=
| (1-X)2 |
| X2•(0.5+0.5X) |
| 80 |
| 3 |
| 0.2mol |
| 1mol |
故答案为:20%;吸收;19.66;
(2)①由图象可知,3min-09min内二氧化碳浓度减少了0.25mol/L,则该时间段内氢气的浓度减少3×0.25mol/L=0.75mol/L,则v(H2)=
| 0.75mol/L |
| 6min |
故答案为:0.125;
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1时,没有达到平衡状态,故A错误;
B.由于气体的总质量不变,容器的体积不变,则无论是否达到平衡状态,气体的密度都不变,故B错误;
C.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故答案为:D;
(3)A、依据平衡常数随温度变化和平衡移动原理分析判断,随温度升高平衡常数减小,正反应为放热反应,故A正确;
B、由A得正反应为放热反应,△H<0,根据△G=△H-T△S<0自发,△G=△H-T△S>0非自发,又在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
,故B正确;
C、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.1 0.2 0
变化量(mol/L) 0.1×50% 0.1 0.05
平衡量(mol/L) 0.05 0.1 0.05
平衡常数K=
| 0.05 |
| 0.05×0.12 |
D、升温平衡逆向进行,此条件是催化剂活性最大,不是原料气的转化率高,故D错误;
故选ABC.
看了(1)恒温,容积为1L恒容条件...的网友还看了以下:
超急,一道很简单的题假设生产函数Q=K的0.5次方L的0.5次方,劳动价格w=2,资本价格r=3, 2020-05-13 …
大一微观经济学习题已知生产函数Q=f(L,K)=2KL-0.5²-0.5K²,假定厂商目前处于短期 2020-06-11 …
如题L(i+1)=numel(l(l==i)是啥意思呢?hist函数将图像进行重叠方式分块,提取图 2020-06-12 …
铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:(l)生铁中含有一种铁碳化合物(Fe3C) 2020-07-08 …
关于微观经济学生产理论的计算题~~~关于微观经济学生产理论的题目设生产函数为Q=L^4K^2问:( 2020-07-30 …
测定杨氏模量的问题,1,实验中,各长度量用不同的仪器来测量,是怎样考虑的?2,利用光杠杆测微小长度 2020-08-02 …
如图表示生长素对植物根、芽和茎的生理作用,下列分析正确的是()A.10-8mol•L-l的生长素促进 2020-11-05 …
微观经济学题已知生产函数Q=f(L,K)=2KL-0.5L^2-0.5K^2,假定厂商目前处于短期生 2020-11-06 …
你帮我回答的化简函数很厉害,你还可以帮我化简几道题吗?用卡诺图法化简1题L=∑m(0,1,3,5,7 2020-12-23 …
帮忙解一道题,微观经济学试题已知生产函数Q=f(K,L)=Kl-0.5L2-0.32K2,K表示资本 2021-01-22 …