早教吧作业答案频道 -->化学-->
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等.钡盐行业生产中排出大量的钡泥,某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流
题目详情
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等.钡盐行业生产中排出大量的钡泥,某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
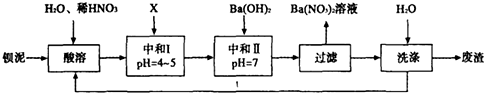
已知:①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤.试用离子方程式说明提纯原理:___;
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:___;
(3)该厂结合本厂实际,选用的X为___(填序号);
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)中和I使溶液的pH为4~5目的是___;结合离子方程式简述原理___.
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是___;
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m g,则该晶体的纯度为___.

已知:①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤.试用离子方程式说明提纯原理:___;
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:___;
(3)该厂结合本厂实际,选用的X为___(填序号);
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)中和I使溶液的pH为4~5目的是___;结合离子方程式简述原理___.
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是___;
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m g,则该晶体的纯度为___.
▼优质解答
答案和解析
钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,过滤得到的固体洗涤后除去废渣,滤液重新加入酸溶步骤充分利用;
(1)溶液存在BaSO4(aq)+CO32-(aq)⇌BaCO3(aq)+SO42-(aq),当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化,
故答案为:BaSO4(aq)+CO32-(aq)⇌BaCO3(aq)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,
所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3 =Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,
故答案为:B;
(4)Fe3+易发生水解而生成Fe(OH)3沉淀,离子方程式为Fe3++3H2O⇌Fe(OH)3+3 H+,加入碳酸钡,BaCO3消耗H+使Fe3+水解平衡右移,形成Fe(OH)3沉淀,
故答案为:使Fe3+完全沉淀;Fe3++3H2O⇌Fe(OH)3+3 H+,BaCO3消耗H+使Fe3+水解平衡右移,形成Fe(OH)3沉淀;
(5)从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,然后过滤,所以操作Ⅲ为蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩,冷却结晶;
(6)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则
=
,
解得x=
,
所以该Ba(NO3)2的纯度为
×100%=
×100%,
故答案为:
×100%.
(1)溶液存在BaSO4(aq)+CO32-(aq)⇌BaCO3(aq)+SO42-(aq),当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化,
故答案为:BaSO4(aq)+CO32-(aq)⇌BaCO3(aq)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,
所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3 =Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,
故答案为:B;
(4)Fe3+易发生水解而生成Fe(OH)3沉淀,离子方程式为Fe3++3H2O⇌Fe(OH)3+3 H+,加入碳酸钡,BaCO3消耗H+使Fe3+水解平衡右移,形成Fe(OH)3沉淀,
故答案为:使Fe3+完全沉淀;Fe3++3H2O⇌Fe(OH)3+3 H+,BaCO3消耗H+使Fe3+水解平衡右移,形成Fe(OH)3沉淀;
(5)从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,然后过滤,所以操作Ⅲ为蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩,冷却结晶;
(6)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则
| 261 |
| x |
| 233 |
| mg |
解得x=
| 261m |
| 233 |
所以该Ba(NO3)2的纯度为
| ||
| w |
| 261m |
| 233w |
故答案为:
| 261m |
| 233w |
看了Ba(NO3)2可用于生产绿色...的网友还看了以下:
硫酸钡结晶水合物(化学式)?还有石膏的化学式? 2020-05-13 …
实验室用共沉淀法制备纳米级Fe3O4的流程如下:该方法的关键为促进晶粒形成,并控制晶体生长.试回答 2020-05-14 …
硫酸钡可由Ba(OH)2和稀硫酸反应制得,反应的化学方程式为什么 2020-05-14 …
钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等. 2020-06-22 …
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO 2020-06-22 …
默写初中阶段常见的元素符号(34个)名称氢碳符号名称钠符号Na名称钡符号Ba名称 2020-07-17 …
自制晶体,急!如何自制食盐晶体? 2020-11-24 …
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等.钡盐行业生产中排出大量的钡泥,某主 2020-12-22 …
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等.某生产BaCO3、BaSO4的化工厂生产中排 2020-12-22 …
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排 2020-12-22 …