早教吧作业答案频道 -->化学-->
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.(1)工业上可以利用CO为原料制取CH3OH.已知:CO2(g)+3H2(g)⇌CH2OH(g)+H2O(g)△H=-49.5kJ•mol-1CO2(g)+H2(g)
题目详情
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
(1)工业上可以利用CO为原料制取CH3OH.
已知:CO2(g)+3H2(g)⇌CH2OH(g)+H2O(g)△H=-49.5kJ•mol-1
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H=+41.3kJ•mol-1
(1)写出由CO和H2制取甲醇的热化学方程式___;
(2)(1)中反应能自发进行的条件是___;
(3)某温度下,(1)中反应的平衡常数K=0.25,改变下述条件可使K=2.04的有___.
A.增大压强 B.增大CO的密度 C.升高温度 D.降低温度 E.使用催化剂
(II)工业是也可以利用CO2为原料制取CH3CH2OH.下面为CO2和H2制取乙醇的反应:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O (g)△H=QkJ/mol(Q>0)z
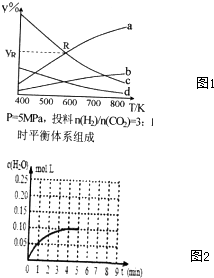
在密闭容器中,按CO2与H2的物质质量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各物质的体积分数(y%)如图1所示.
(1)图1中表示CH3CH2OH体积分数曲线的是___;
(2)在一定温度下反应达到平衡的标志是___.
A.平衡常数K不再增大;
B.CO2的转化率不再增大;
C.混合气体的平均相对分子质量不再改变;
D.反应物不再转化为生成物.
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是___,达到平衡后,能提高H2的转化率的操作是___.
A.降低温度B.充入更多的H2 C.移去乙醇 D增大容器体积
(4)图1中曲线a和c的交点R对应物质的体积分数ya=___%.
(III)一定条件下CO可转化为CO2,温度T1时,CO(g)+H2O(g)⇌CO2(g)+H2(g),在体积为2L的密闭容积中加入0.4molCO2和0.4molH2,第4分钟达到平衡,反应中c(H2O)的变化情况如图2所示.在第5分钟时,向体系中再充入0.2molCO和0.2molH2O(其他条件不变).第8分钟达到平衡,请在图2中画出5到9分钟的c(H2O)浓度变化趋势的曲线.

(1)工业上可以利用CO为原料制取CH3OH.
已知:CO2(g)+3H2(g)⇌CH2OH(g)+H2O(g)△H=-49.5kJ•mol-1
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H=+41.3kJ•mol-1
(1)写出由CO和H2制取甲醇的热化学方程式___;
(2)(1)中反应能自发进行的条件是___;
(3)某温度下,(1)中反应的平衡常数K=0.25,改变下述条件可使K=2.04的有___.
A.增大压强 B.增大CO的密度 C.升高温度 D.降低温度 E.使用催化剂
(II)工业是也可以利用CO2为原料制取CH3CH2OH.下面为CO2和H2制取乙醇的反应:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O (g)△H=QkJ/mol(Q>0)z
在密闭容器中,按CO2与H2的物质质量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各物质的体积分数(y%)如图1所示.
(1)图1中表示CH3CH2OH体积分数曲线的是___;
(2)在一定温度下反应达到平衡的标志是___.
A.平衡常数K不再增大;
B.CO2的转化率不再增大;
C.混合气体的平均相对分子质量不再改变;
D.反应物不再转化为生成物.
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是___,达到平衡后,能提高H2的转化率的操作是___.
A.降低温度B.充入更多的H2 C.移去乙醇 D增大容器体积
(4)图1中曲线a和c的交点R对应物质的体积分数ya=___%.
(III)一定条件下CO可转化为CO2,温度T1时,CO(g)+H2O(g)⇌CO2(g)+H2(g),在体积为2L的密闭容积中加入0.4molCO2和0.4molH2,第4分钟达到平衡,反应中c(H2O)的变化情况如图2所示.在第5分钟时,向体系中再充入0.2molCO和0.2molH2O(其他条件不变).第8分钟达到平衡,请在图2中画出5到9分钟的c(H2O)浓度变化趋势的曲线.
▼优质解答
答案和解析
(1)①CO2(g)+3H2(g)⇌CH2OH(g)+H2O(g)△H=-49.5kJ•mol-1②CO2(g)+H2(g)⇌CO(g)+H2O(g)△H=+41.3kJ•mol-1 盖斯定律计算①-②得到由CO和H2制取甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)...
看了环境问题正引起全社会关注,CO...的网友还看了以下:
CO是大气污染物之一.用氯化钯(PdCl2)可以测定微量CO的存在,该反应的化学方程式为PdCl2 2020-05-17 …
CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题.(1)①用CO、O2和KO 2020-07-14 …
工业常用燃料与水蒸气反应制各H2和CO,再用H2和CO合成甲醇.(1)制取H2和CO通常采用:C( 2020-07-17 …
工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇.(1)制取H2和CO通常采用:C( 2020-07-17 …
工业常用燃料与水蒸气反应制各H2和CO,再用H2和CO合成甲醇.(1)制取H2和CO通常采用:C( 2020-07-18 …
工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇.(1)制取H2和CO通常采用:C( 2020-07-18 …
金属单质钴(Co)能与盐酸发生反应:Co+2HCl=CoCl2+H2↑,下列判断正确的是()A.钴的 2020-11-01 …
CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)⇌CH3OH(g).CO在不同温度下的平衡转 2020-11-05 …
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程 2020-11-20 …
甲醇是一种重要的可再生能源,可以通过下列反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g).( 2020-11-22 …